
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




以下,分別來分析化藥、中藥、生物製品的申報受理及審評審批情況。
一、化藥
申報受理情況:
4月份CDE共承辦新的化藥注冊申請以受理號計728個,涉及327個品種。其中各個申請類型的具體數據如下所示:
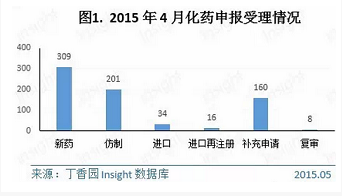
1.新藥
(1)1.1類新藥
8個化藥1.1類新藥申報臨床
根據Insight數據庫統計,4月份CDE共承辦化藥1.1類新藥申請以受理號計有23個,涉及8個品種,且均為新藥臨床申請。具體數據如下所示:
正大天晴申報的TQ-B3234具體適應症暫時不詳。這是正大天晴繼2011年申報舒布替尼之後,近4年來申報的唯一一個化藥1.1類新藥。正大天晴是國內仿製藥領域領先的醫藥企業,但其在創新藥物研發領域仍有待加強,其目前還沒有獲批上市的1.1類新藥。
丹諾醫藥申報的TNP-2092為消化道感染用藥。除了TNP-2092之外,其研發管道上還有尚未申報的具有不同滅菌機理的雙靶標分子新藥候選物TNP-2198和TNP-2500。
萘福帕羅,是山東亨利繼阿莫奎尼之後申報的第2個1.1類新藥。根據山東亨利現有的產品線研發進展推測該藥即為KBP-7026,為選擇性的趨化因子受體(CRTh2)抑製劑,用於治療炎症和自身免疫性疾病,如哮喘和慢性阻塞性肺病。
羅氏申報的RO6889678,為咪達唑侖同類藥物,催眠鎮靜藥。江蘇豪森申報的HS-10241為c-Met抑製劑,抗腫瘤新藥。
倍他替尼,為EGFR抑製劑,用於治療非小細胞肺癌。該藥是由精華製藥以出資1000萬元及未來銷售提成的方式從Aspedia公司購得其國內及港澳地區獨占的專利使用權。
阿斯利康申報的AZD3759,用於治療非小細胞肺癌。歌禮生物科技申報的ASC16為NS5A抑製劑,丙肝治療藥物。
(2)3.1類新藥
齊魯製藥搶仿迅速,糖尿病熱門新藥曲格列汀遭國內藥企爭相仿製
4月份CDE共承辦新的化藥3.1類新藥申請以受理號計有210個。其中臨床申請有195個,涉及65個品種;上市申請15個,涉及12個品種。
維莫德吉(Vismodegib),由羅氏子公司基因泰克研發,於2012年1月獲得美國FDA批準上市,用於治療成人最常見的皮膚癌——基底細胞癌。這也是FDA批準的首個治療轉移性基底細胞癌的藥物。
貝洛替康(Belotecan),為喜樹堿類抗癌藥物,由韓國鍾根堂製藥公司研發,2004年在韓國首次上市,用於治療小細胞肺癌和卵巢癌。
卡非佐米(Carfilzomib),由安進子公司Onyx公司研發,2012年7月獲得美國FDA批準上市,用於至少接受過兩種其它藥物治療後疾病出現惡化的多發性骨髓瘤患者的治療。石藥集團是國產廠家中首次申報,但在此之前安進已申報進口。
帕布昔利布(Palbociclib),是一種選擇性CDK4/6抑製劑。今年2月份剛獲得美國FDA批準上市,商品名為Ibrance,用於治療絕經後婦女的晚期/轉移性乳腺癌。這也是目前首個獲得FDA批準的CDK4/6抑製劑。輝瑞於2013年5月在國內申報進口新藥臨床,2014年7月獲批臨床,目前處於臨床試驗階段。齊魯製藥是國內首個申報的國產廠家。
曲格列汀,是一種超長效DPP-4抑製劑,武田製藥於今年3月份剛在日本獲批上市,商品名為Zafatek。它是全球首個已上市的每周僅需口服一次的降糖藥,無疑將為糖尿病患者提供更為方便的治療選擇。齊魯製藥是國內首個申報該藥的廠家,搶仿迅速。截至目前,重慶醫工院、東陽光也已緊隨齊魯之後提交了該藥的注冊申請,競爭亦是相當激烈。
2.仿製
仿製藥申報情況相對穩定
4月份,CDE共承辦化藥仿製藥新申請以受理號計有201個,涉及111個品種,116家企業(未合並同集團下子公司),數量上與3月份近乎持平。這些品種主要集中在消化道及代謝用藥、神經係統、抗感染用藥、心血管係統等治療領域。
3.進口
GSK提交多替拉韋進口上市申請
4月份CDE共承辦新的化藥進口注冊申請以受理號計有34個,共涉及28個品種。其中,臨床申請有17個品種,上市申請有11個品種。其中,葛蘭素史克的多替拉韋(Dolutegravir)為國內首次上市申請。
多替拉韋,由葛蘭素史克旗下ViiV公司研發,分別於2013年8月和2014年1月在美國和歐洲獲批上市,商品名為Tivicay。它是全球繼默沙東的拉替拉韋之後已上市的第二個HIV整合酶抑製劑。
另外,多替拉韋拉米夫定阿巴卡韋的三合一HIV藥物,也分別於2014年8月和9月在美國和歐盟獲批上市,商品名為triumeq。
審批情況:
6個化藥
1.1類新藥獲得臨床批件
根據Insight數據庫統計,4月份共有6個化藥1.1類新藥獲得臨床批件,江蘇恒瑞、江蘇豪森、江蘇恩華等企業均有斬獲。
二、中藥
4月份CDE共承辦中藥新申請以受理號計有39個,數量上與往期近乎持平。其中新藥申請11個,補充申請27個,複審1個。
三、生物製品
4月份CDE共承辦生物製品新申請以受理號計有69個。
其中1類新藥有2個品種,均為臨床申請。分別是北京天壇生物的H7N9流感病毒裂解疫苗、信達生物製藥的重組人血管內皮生長因子受體-抗體-人補體受體1融合蛋白注射液。
來源:醫藥網