- 轉化醫學以藥物研發過程中生物標誌物為核心,以精準醫療提高藥物研發臨床應答率為目標,覆蓋從早期靶點確認——臨床前R&D ——臨床I、II、III期Development,到上市後的藥物檢測,通過不同階段的研究實現藥物研發的閉環。
- 01

- 02

- 03

- 04臨床研究

- 05上市
隨著基因組學、蛋白質組學和代謝組學等多組學分析技術不斷地發展,治療方式已經從傳統小分子擴展到多肽、蛋白、抗體、基因療法、細胞療法等多種新型技術。盡管有這些新技術,但仍有大量疾病的致病原因還無法徹底明白。轉化醫學將生物醫學觀察和研究轉化為改善健康的幹預措施的過程,加速了基礎研究、新藥開發的和臨床轉化的進程,成為精準靶向治療的加速器。轉化醫學研究利用各種研究手段,確定靶點與疾病發生發展的關係、驗證和探索藥物的作用機製、發現生物標誌物並開發伴隨診斷產品,以及為臨床研究開展篩選最合適的人群和適應症等,從而提高新藥研發效率和成功率。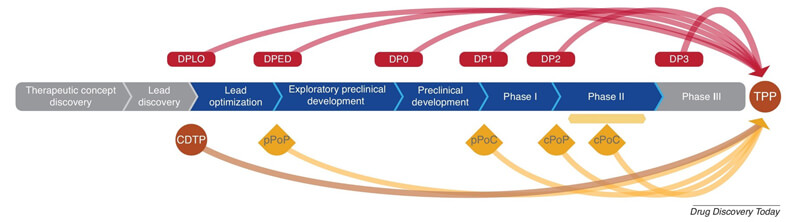 將轉化醫學裏程碑疊加到藥物開發階段[1]hjc黄金城請回答:什麽是轉化醫學
將轉化醫學裏程碑疊加到藥物開發階段[1]hjc黄金城請回答:什麽是轉化醫學
 服務平台
服務平台 免疫組化技術平台
免疫組化技術平台- 免疫組化簡介免疫組化,也稱免疫組織化學技術(immunohistochemistry)或免疫細胞化學技術(immunocytochemistry)。是指應用免疫學基本原理即抗原與抗體特異性結合的原理,通過化學反應使標記抗體的顯色劑顯色來確定組織細胞內抗原(多肽和蛋白質),對其進行定位、定性及相對定量的研究。根據抗原抗體反應和化學顯色的原理,組織切片或細胞樣本中的抗原先和一抗結合,再利用一抗與二抗反應,DAB進行顯色,進而進行分析。主要步驟組織處理、固定、切片抗原修複除去內源性過氧化物酶封閉一抗、二抗孵育檢測複染
- 組織處理、固定、切片組織固定可保存抗原,防止采集的組織自溶和壞死。組織包埋可在切片過程中對組織提供支撐,使切片更堅實。
石蠟切片 冰凍切片 固定 包埋前:甲醛 切片前或切片後:甲醛、甲醇、乙醇或丙酮 切片 切片機 冰凍切片機 儲存 室溫下儲存多年 -80 °C下儲存1年 (-190°C下儲存時間更長) 優勢 容易操作,不會損壞切片 ♦ 保留酶的功能和抗原性
♦ 實驗流程簡短(通常不需要冗長的固定步驟)
局限性 ♦ 過度固定會掩蓋抗原表位,進而增加抗原修複的需求
♦ 處理時間長:在梯度酒精和二甲苯中逐步脫水,以便於石蠟滲透。
♦ 如果沒有快速冷凍組織”可能會形成冰晶,從而破壞組織結構
♦ 冰凍切片通常比石蠟切片厚,可能會導致分辨率低、圖像差
♦ 可能需要阻斷內源活性酶。
石蠟切片 vs冰凍切片 - 處理流程
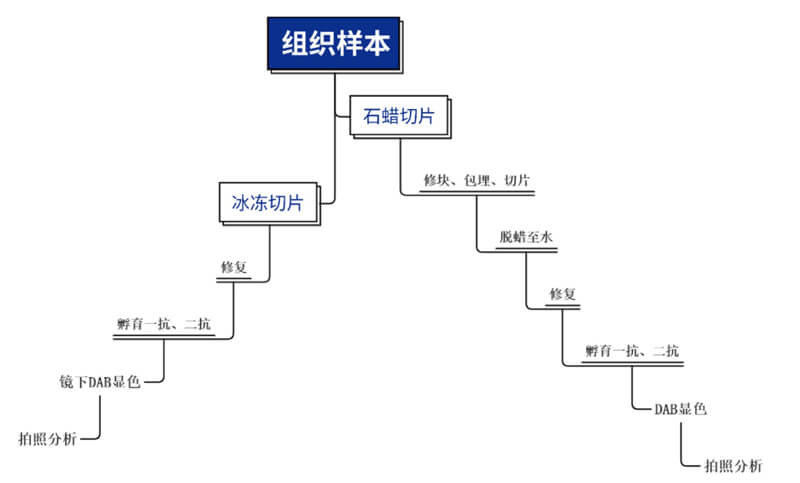
- 抗原修複對甲醛固定的組織切片進行抗原修複,以暴露抗原位點,從而使抗體結合。
熱誘導的抗原表位修複 蛋白水解酶誘導的抗原表位修複 優勢 抗原表位的修複更溫和,參數更可控。 適用於較難修複的抗原表位。 ph值 通常使用pH6的緩衝液,但堿性緩衝液也在廣泛使用。必須通過實驗確定 pH值通常為7.4。 溫度 約95°C。 通常為37°C 孵育時間 10-20分鍾 10-15分鍾 緩衝液組分 取決於靶抗原所需的pH 值。常用的緩衝液包括檸檬酸鈉、EDTA和Tris-EDTA 酶(如胃蛋白酶、蛋白酶K 或胰蛋白酶)的中性緩衝液。 注意事項 微波爐加熱可能會導致抗原修複不均勻。劇烈沸騰會導致脫片(組織與載玻片分離)。 酶修複有時會破壞切片的形態- 濃度和時間需要優化 抗原修複的主要方法 - 封閉用血清或BSA封閉,防止抗體的非特異性結合,並降低背景和潛在的假陽性結果。❖ 蛋白封閉:使用血清或BSA 進行封閉對於防止抗體與組織或Fc 受體(與抗體恒定區(Fc)結合的受體)發生非特異性結合至關重要。二抗種屬來源的血清是很好的封閉試劑。使用牛血清白蛋白(BSA)或酪蛋白,可用於阻斷非特異性抗體結合。❖ 生物素封閉:在使用基於親和素/生物素的檢測係統時,阻斷內源性生物素,因為內源性生物素存在於許多組織中,特別是腎髒、脾髒、肝髒和大腦中。用親和素與組織孵育,阻斷內源生物素,然後用外源生物素孵育,以阻斷親和素分子上額外的生物素結合位點。
- 檢測❖ 酶顯色法:顯色檢測使用酶能夠催化可溶性底物產生有色沉澱。這些酶通常偶聯在二抗上,也可以偶聯在一抗上用於直接檢測。最常用的酶有HRP 和AP,前者將DAB 轉化成棕色產物,後者將3-氨基-9-乙基哢唑 (AEC) 轉化成紅色產物。顯色檢測通常比熒光檢測更靈敏。此外,不同於熒光染料,有色沉澱物有光穩定性,因此染色切片能夠保存多年。熒光檢測需要使用專業熒光顯微鏡和濾光片,顯色檢測僅需使用標準顯微鏡。然而,顯色檢測的孵育和封閉步驟比熒光法更多,時間也更長。❖ 熒光法:熒光檢測(免疫熒光)是基於熒光基團被特定波長的光激發後發射波長較長的熒光的特性。熒光檢測常常用於需要同時檢測多種抗原的情況。熒光染料可以與一抗或二抗直接偶聯,也可與鏈黴素親和素偶聯。
- 案例賞析:PD-L1, Ki-67, Her2, CD31, CD163, FoxP3
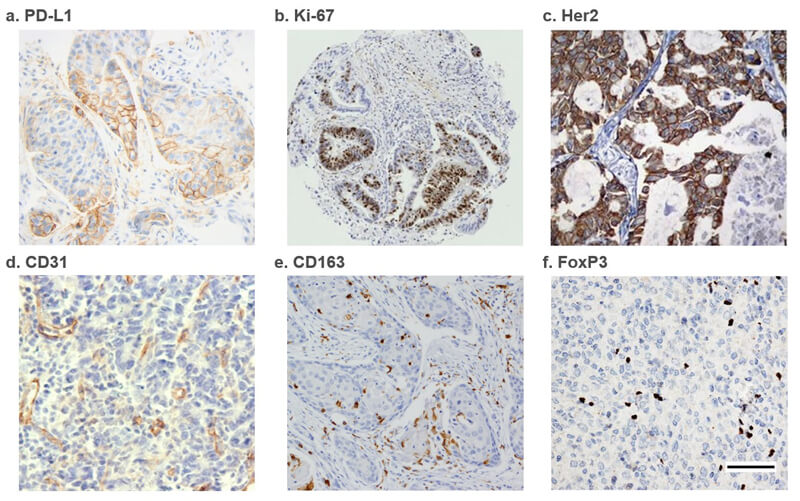 IHC Analysis of the expression ofa)PD-L1 from lung adenocarcinoma[3]; b)Ki-67 from periampullary tumors[4]; c)Her2 from lung tumor[5]; d)CD31 from human gastric adenocarcinoma[6]; e)CD163 (M2 TAM marker) from oral squamous cell carcinoma (OSCC)[7]; f)FoxP3 from human glioblastoma[8].
IHC Analysis of the expression ofa)PD-L1 from lung adenocarcinoma[3]; b)Ki-67 from periampullary tumors[4]; c)Her2 from lung tumor[5]; d)CD31 from human gastric adenocarcinoma[6]; e)CD163 (M2 TAM marker) from oral squamous cell carcinoma (OSCC)[7]; f)FoxP3 from human glioblastoma[8].
 總結與展望
總結與展望- 基於基因組學、蛋白組學、細胞組學及病理組學等綜合性轉化醫學平台;高質量的研發管理團隊;hjc黄金城轉化醫學平台致力於為全球合作夥伴提供全方位生物標誌物發現、靶點驗證、伴隨診斷開發與商業化檢測等一體化解決方案。❖ 以ELISA、ECL(MSD), SIMOA(HD-X), Biacore 8K 技術構建的的蛋白質相互作用,蛋白水平生物標誌物平台;❖ 以流式細胞術(BD Symphony A3,BD Fortesssa, Beckman CytoFLEX S)為主構建的細胞水平生物標誌物平台;❖ 以熒光定量PCR技術構建的多重核酸水平生物標誌物平台;❖ 免疫組化(TAMs-IHC,FISH)技術構建的病理水平生物標誌物平台等。
- 參考文獻:[1] Hugues Dolgos, et al. Translational Medicine Guide transforms drug development processes: the recent Merck experience. Drug Discov Today. 2016 Mar;21(3):517-26. doi: 10.1016/j.drudis.2016.01.003.[2] Ying Xu, et al. A Selective Small-Molecule c-Myc Degrader Potently Regresses Lethal c-Myc Overexpressing Tumors. Adv Sci (Weinh). 2022 Mar;9(8):e2104344. doi: 10.1002/advs.202104344.[3] Jonas J Heymann, et al. PD-L1 expression in non-small cell lung carcinoma: Comparison among cytology, small biopsy, and surgical resection specimens. Cancer Cytopathol. 2017 Dec;125(12):896-907. doi: 10.1002/cncy.21937.[4] Mark M Aloysius, et al. Predictive value of tumor proliferative indices in periampullary cancers: Ki-67, mitotic activity index (MI) and volume corrected mitotic index (M/V) using tissue microarrays. World J Surg. 2010 Sep;34(9):2115-21. doi: 10.1007/s00268-010-0681-3.[5] Montse Verdu, et al. Cross-reactivity of EGFR mutation-specific immunohistochemistry assay in HER2-positive tumors. Appl Immunohistochem Mol Morphol. 2015 Sep;23(8):565-70.[6] Qingling Wang, et al. EPCR promotes MGC803 human gastric cancer cell tumor angiogenesis in vitro through activating ERK1/2 and AKT in a PAR1-dependent manner. Oncol Lett. 2018 Aug;16(2):1565-1570. doi: 10.3892/ol.2018.8869.[7] Faustino J Suárez-Sánchez, et al. Macrophages in Oral Carcinomas: Relationship with Cancer Stem Cell Markers and PD-L1 Expression. Cancers (Basel) (IF: 6.13; Q1). 2020 Jul 2;12(7):1764. doi: 10.3390/cancers12071764.[8] Qi Yue, et al. The prognostic value of Foxp3+ tumor-infiltrating lymphocytes in patients with glioblastoma. J Neurooncol. 2014 Jan;116(2):251-9. doi: 10.1007/s11060-013-1314-0. Epub 2013 Nov 26.[9] Christopher P Austin.Opportunities and challenges in translational science. Clin Transl Sci. 2021 Sep;14(5):1629-1647. doi: 10.1111/cts.13055.

 關於我們
關於我們