2015年7月CDE 藥品審評報告
CFDA發布2項公告,以解決藥品審評問題
7個1.1類新藥品種申報臨床
3.1類首家搶仿集中神經係統領域
7個進口化藥首次在中國申報臨床
百濟神州、江蘇恒瑞等收獲
1.1類新藥獲批臨床
對於藥品研發和注冊人員來說,7月注定是騷動的一個月。
7月22日,國家食品藥品監督管理局(CFDA)發布公告,要求1622個受理號的申請注冊人開展藥物臨床試驗數據自查核查工作,如不能確保臨床試驗數據的真實性、可靠性和完整性,則需自主撤回注冊申請。
7月31日,CFDA再次發布公告,向社會征求解決藥品注冊申請積壓問題的意見,欲提高仿製藥審批標注,同時優化和改變生物等效性試驗審評程序,並解決積壓的同品種、注冊申報造假行為等問題。
CFDA連續出台政策,下定決心整改藥品注冊審評,但目前效果如何尚不可知。
在臨床試驗自查核查結果以及征求意見水落石出之前,我們一起來回顧下7月的藥品審評情況。
根據丁香園Insight-China Pharma Data 數據庫最新統計,2015年7月CDE 共承辦新的藥品注冊申請有845個(以受理號計,下同),與6月份(783個)相比有所增長,增長量主要來源於化藥。
以下,分別來分析化藥、中藥、生物製品的申報受理及審評審批情況。
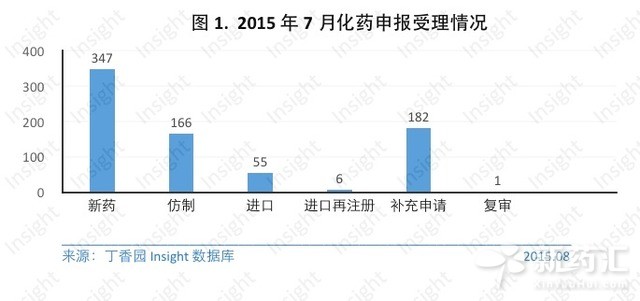
一、化藥申報受理情況:
7月份CDE共承辦新的化藥注冊申請以受理號計757個。其中各個申請類型的具體數據如下所示:
1.新藥
(1)1.1類新藥
7 個 1.1類新藥品種申報臨床根據Insight數據庫統計,7月份CDE共承辦化藥1.1類新藥申請以受理號計有23個,涉及7個品種,均為臨床申請。具體數據如下所示:
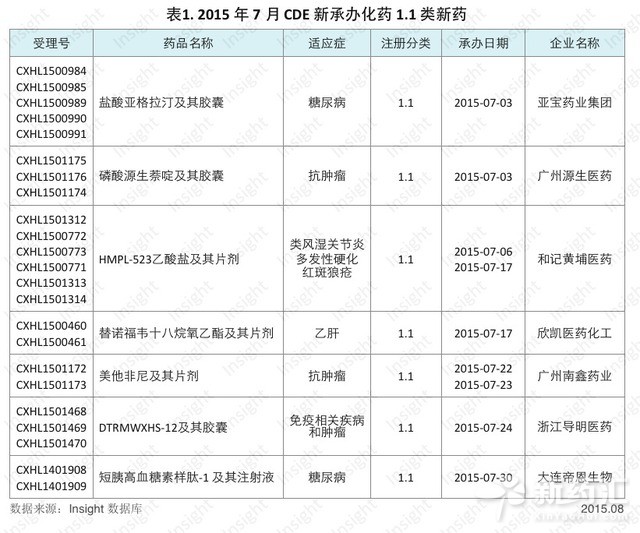
鹽酸亞格拉汀是亞寶藥業集團與禮來製藥合作開發的降糖藥,也是亞寶藥業集團申報的第一個1.1類新藥。亞格拉汀可促進胰島素的分泌外並同時減少肝髒葡萄糖的輸出,從而達到降糖的效果。
源生萘啶是廣州源生申報的Wnt通路抑製劑,用於治療腫瘤和纖維化重大疾病。該藥物屬於特殊審評通道,目前排在IND序列434號。
和記黃埔是一家專注炎症和抗腫瘤領域的新藥研發企業,2009年起,共申報了7個1.1類新藥。此次申報的HMPL-523是一種選擇性Syk抑製劑,用於治療類風濕關節炎、多發性硬化、紅斑狼瘡等疾病。
欣凱醫藥現有產品線為腎髒病與代謝性疾病和血液病領域,欣凱以替諾福韋十八烷氧乙酯來開創抗感染領域。然而,替諾福韋酯類藥物已上市多年,並且其1.1類和3.1類申報企業已達10餘家。
廣州南新的帕拉米韋三水合物在兩年前的禽流感時期獲批上市從而被業內關注,今年7月,廣州南鑫藥業(南新的異地新廠)又申報了一個1.1類抗腫瘤新藥美他非尼片劑。南鑫藥業的大股東是湖南有色凱鉑生物藥業公司,另外廣州白雲山也持有 13% 的股份。
浙江導明醫藥是海正藥業的控股子公司,目前持有CN103896946A和CN104059054A兩項公開專利,因此其申報的DTRMWXHS-12可能是JAK抑製劑或者ALK抑製劑。
大連帝恩生物工程於7月底申報了1.1類新藥短胰高血糖素樣肽-1及其注射液。而此前,大連帝恩未申報過任何藥品。該藥是大連帝恩生物與大連大學生物工程學院合作的「十一五重大專項」項目,大連帝恩還持有短胰高血糖素樣肽-1的2項相關專利,公開號為 CN1927888B、CN100374462C。
(2)3.1 類新藥
3.1 類首家搶仿集中神經係統領域7月份CDE共承辦新的化藥3.1類新藥申請以受理號計有228個。其中臨床申請有213個,涉及83個品種;上市申請15個,涉及9個品種。
我們根據Insight數據庫的潛力品種篩選係統,篩選出在國內首次申報3.1類新藥臨床和上市的品種,它們未來或有可能成為國內首仿。具體數據如下所示:
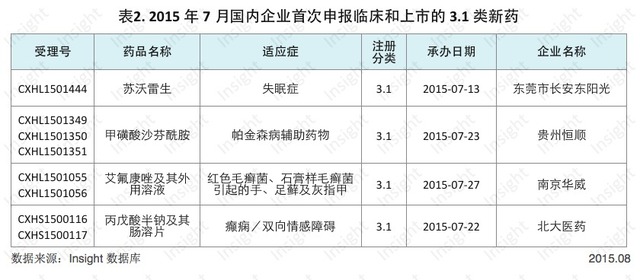
蘇沃雷生(Suvorexant,商品名 Belsomra)是默克公司於2014年8月獲FDA批準的失眠藥,這是首款獲批用於治療難以入睡或保持睡眠的食欲素受體拮抗劑,蘇沃雷生還曾經因劑量和安全問題遭到FDA拒絕。東莞市長安東陽光在這款藥物獲批一年後,搶先在國內申報。
甲磺酸沙芬酰胺(Safinamide,商品名 Xadago)是Newron公司的帕金森病輔助治療藥物,用於其他治療無效的早期和中晚期PD患者,這款MAO-B和多巴胺重攝取抑製劑於2015年2月在歐盟獲批上市。該藥物上市不到6個月時間,貴州恒順就已經在國內提交申報。
艾氟康唑(Efinaconazole,商品名 Jublia)最早由加拿大DOW製藥公司研發,於2014年6月獲FDA批準,用於治療難以治愈的紅色毛癬菌、石膏樣毛癬菌引起的手、足蘚及灰指甲。CRO公司南京華威醫藥在國內首先搶仿了該藥。
北大醫藥此次申報的丙戊酸半鈉主要用於治療癲癇和雙向情感障礙,該藥的臨床批件由同屬方正集團的方正醫藥研究院獲得。丙戊酸半鈉由雅培製藥研發,且已上市十餘年,但一直未進入中國,因此方正集團有望獲得國內首家批準上市。
2. 仿製
仿製藥申請數量下降7月份,CDE共承辦化藥仿製藥新申請以受理號計有166個,涉及99個品種,101家企業(未合並同集團下子公司)。
根據Insight數據庫,過去一年仿製藥每月新申請受理號數量平均為172個,今年7月的仿製藥申請數量有所下降,但仿製藥重複申報的整體趨勢並未減弱。
3. 進口
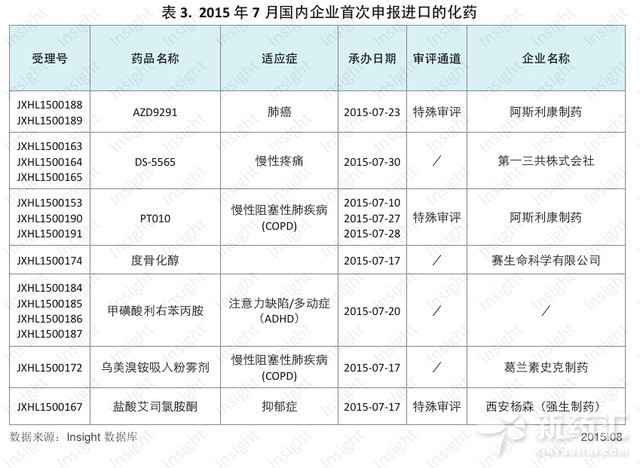
7個進口化藥首次在中國申報臨床7月份CDE共承辦新的化藥進口注冊申請以受理號計有55個,共涉及30個品種。其中,臨床申請有41個,涉及23個品種,上市申請有14個,涉及8個品種。
其中,7個品種首次在中國申報臨床,具體數據如下:
化藥審批情況:
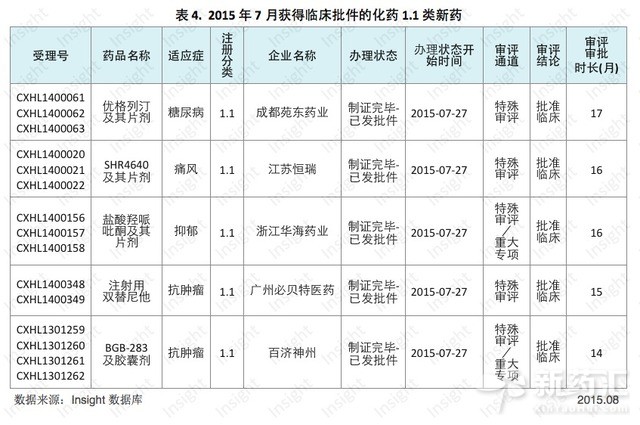
百濟神州、江蘇恒瑞等多家企業收獲1.1類新藥獲批臨床
根據Insight數據庫統計,百濟神州、廣州必貝特醫藥、浙江華海藥業、江蘇恒瑞、成都苑東藥業五個企業7月份收獲了5個化藥1.1類新藥的臨床批件(以辦理狀態為「製證完畢-已發批件」為準),具體數據如下所示:
二、中藥
7月份CDE共承辦中藥新申請以受理號計有32個。其中新藥申請僅有10個,補充申請19個,另外還有3個仿製申請。
三、生物製品7月份CDE共承辦生物製品新申請以受理號計有50個,具體受理情況如下所示:
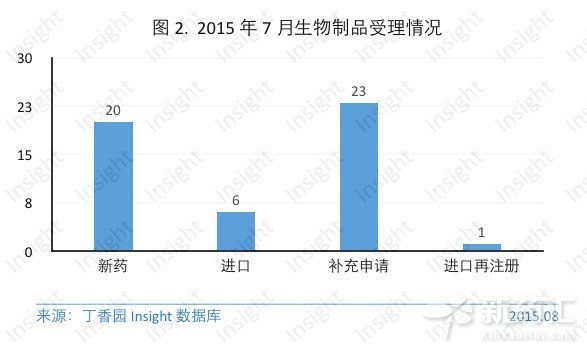
生物製品中,葛蘭素史克的注射用美泊利單抗和武田製藥的注射用Vedolizumab首次在中國申報。
美泊利單抗(mepolizumab)是抗白細胞介素5單克隆抗體,該藥將會是除諾華Xolair以外第二款用於哮喘的生物製品。因FDA專家委員會反對美泊利單抗用於12-17歲患者,目前尚未獲批。
武田的Vedolizumab於2014年5月獲FDA批準,用於治療成人中度至重度活動性潰瘍性結腸炎(ulcerative colitis,UC)和克羅恩病(Crohn's disease,CD)。Vedolizumab是首款可用於UC和CD患者維持性治療的藥物。




















 相關新聞
相關新聞