心血管疾病 (Cardiovascular diseases,CVD) 是全球死亡的主要原因之一。WHO 數據顯示,每年約有 1790 萬人死於心血管疾病,占全球死亡人數的 32%。
基因療法是當今最前沿的技術之一,在治療腫瘤、遺傳性疾病、代謝疾病,預防性傳染病等方麵不斷取得突破性進展。其中,小核酸藥物在心血管領域的應用,將引領常見慢性疾病的治療與管理進入一個全新的治療革命。目前,hjc黄金城在 mRNA,siRNA 等小核酸藥物方麵的多個FTE項目以及 CMC 服務項目已啟動。小核酸藥物將為心血管疾病治療領域開啟新篇章!
心血管疾病主要包含心髒和血管疾病,如冠心病、腦血管疾病、風濕性心髒病和其他疾病等。超過五分之四的心血管疾病死亡是由於心髒病或者中風,其中三分之一的死亡發生在 70 歲以下的人群中。動脈粥樣硬化性心血管疾病 (ASCVD) 是心血管係統疾病中最常見的疾病。ASCVD 涉及動脈中膽固醇斑塊的積聚,包括急性冠狀動脈綜合征、外周動脈疾病以及心肌梗塞和中風等事件。低密度脂蛋白膽固醇 (LDL-C) 水平升高是導致 ASCVD 發生及發展的重要因素,所以降低 LDL-C 水平可以有效降低心血管疾病風險。
心血管疾病的危險因素包括不健康飲食、缺乏運動、吸煙和有害使用酒精。風險因素的影響在個體中可表現為血壓升高、血糖升高、血脂升高以及超重和肥胖。所以盡早發現和加強鍛煉對
心血管疾病的預防尤其重要。另外針對心血管疾病需要早谘詢和早治療。
他汀類藥物療法
除了健康的生活方式幹預外,還可以開始使用他汀類降脂藥物進行藥物治療。2018年,ACC/AHA 指南推薦使用他汀類藥物作為臨床 ASCVD 患者血脂異常管理的一線降脂治療。他汀類藥物治療的強度分為 3 個等級:高強度、中等強度和低強度。高強度他汀治療通常降低 LDL-C 水平≥50%,中強度他汀治療降低 30% 至 49%,低強度他汀治療低於 30%。他汀類藥物治療後 LDL-C 降低的越多,就越高程度地降低風險。當然,LDL-C 降低的幅度在臨床實踐中會有所不同。某些亞洲人群可能對某些他汀類藥物有更大的反應。
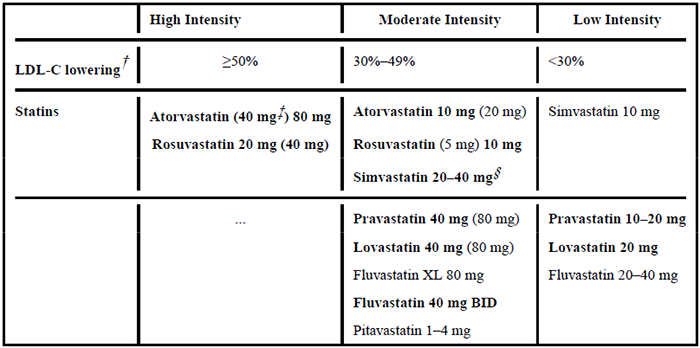
高、中、低強度他汀類藥物治療效果[1]
他汀類藥物雖然能夠有效調節血脂 , 但因需采用聯合用藥 ,導致其副作用發生率較高 ,常見的副作用包括肝毒性、腎毒性、肌毒性、神經毒性,以及心腦血管等方麵的危害。為保證用藥安全 , 在他汀類藥物治療中應當密切對患者的臨床表現進行觀察 , 掌握用藥指征,從而將副作用發生率降至最低。
單抗療法 Alirocumab 和 Evolocumab
前蛋白轉化酶枯草杆菌蛋白酶 kexin 9 (PCSK9) 於 2003 年發現,是參與調控 LDL-C 的重要靶點之一,PCSK9 特異性與肝細胞表麵的低密度脂蛋白受體 (LDL-R) 結合,防止 LDL 再循環並促進 LDL 在內體或溶酶體中降解,從而導致低密度脂蛋白膽固醇清除率降低。PCSK9 以非酶方式增強其所有靶蛋白的細胞內降解。

PCSK9 誘導 LDL-R 降解的細胞內外途徑的示意圖[2]
Alirocumab 和 Evolocumab 是兩種靶向 PCSK9 的人源化單抗,2015 年獲 FDA 批準上市。Alirocumab 和 Evolocumab 能夠將低密度脂蛋白 (LDL) 膽固醇水平降低約 60%。可顯著改善急性冠脈綜合征 (ACS) 後 1-12 個月接受高強度他汀類藥物治療的患者的心血管。在既往患有 ACS 且正在接受高強度他汀類藥物治療的患者中,接受 Alirocumab 或 Evolocumab 的患者複發缺血性心血管事件的風險低於對照組。
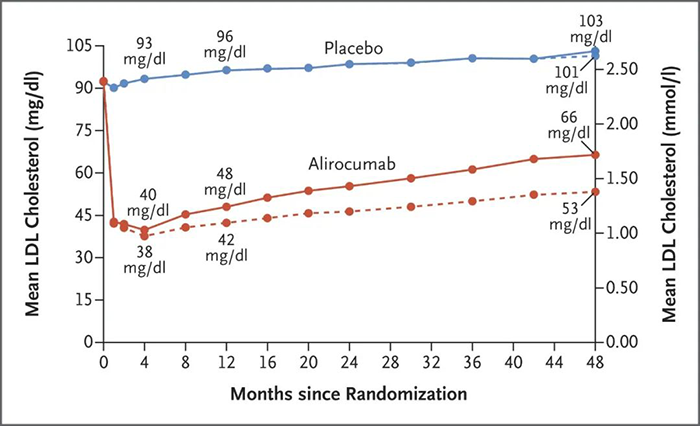
Alirocumab 處理後平均 LDL 膽固醇水平[3]
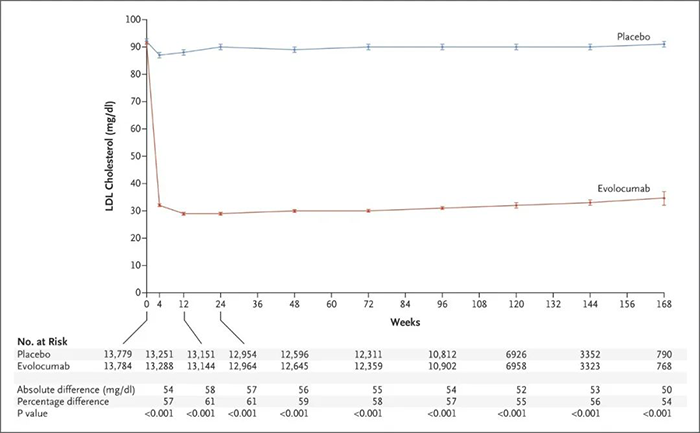
Evolocumab 處理後平均 LDL 膽固醇水平[4]
但 Alirocumab 和 Evolocumab 有其缺點,一、需每兩周皮下注射一次,給藥頻率高。二、年用藥費用價格約為 5800 美金,相比他汀類藥物昂貴。所以這兩款單抗市場銷售額均不太理想。
siRNA 療法 Inclisiran
2021 年 12 月, FDA 批準 Novartis Leqvio® (Inclisiran) 注射液用於治療成人原發性高膽固醇血症 (HeFH)或臨床 ASCVD。Inclisiran 是一種小幹擾 RNA (siRNA),用於抑製 PCSK9 信使 RNA,降低 PCSK9 蛋白的濃度,從而降低 LDL-C 濃度。此外,Inclisiran 還降低總膽固醇、非高密度脂蛋白膽固醇 (non-HDL-C) 、載脂蛋白 B 和甘油三酯。
Inclisiran 是第一個降低膽固醇的 siRNA,作用機製是通過結合和切割靶 mRNA 來幹擾細胞 RNA,進而降低靶蛋白的合成。siRNA 是具有雙鏈的短 RNA 分子,與 RNA 誘導沉默複合物 (RISC) 結合。在 siRNA 結合後,RISC 通過靶向特定的互補 mRNA 分子誘導 mRNA 切割和降解。Inclisiran 將靶向 PCSK9 的雙鏈 siRNA 與靶向肝細胞的 N-乙酰半乳糖胺 (GalNAc) 進行偶聯,提高 siRNA 分子穩定性,同時可實現對肝髒的特異性遞送。Inclisiran 通過去唾液酸糖蛋白受體 (ASGPR) 遞送至肝細胞。然後與 PCSK9 信使 RNA (mRNA) 結合,導致 PCSK9 mRNA 的降解和降低 PCSK9 蛋白質合成。PCSK9 蛋白的減少促進 LDL-R 的循環,增加血漿 LDL-C 的攝取和降解,從而降低血漿 LDL-C 水平。
在 12 個月的隨訪中,通過對 ASCVD 患者進行適當的降脂治療,每年注射兩次 Inclisiran,可持久降低 LDL-C 水平。Inclisiran 的 siRNA 療法在 I 期和 II 期試驗中為降低 LDL-C 提供了一種簡單、新穎且頻率較低的方法,Inclisiran 在 II 期試驗中顯示出其功效、有效性和長期作用。將來可與他汀類藥物聯合使用或單獨使用。因此,Inclisiran 可能為 LDL-C 提供一種新的治療方法。
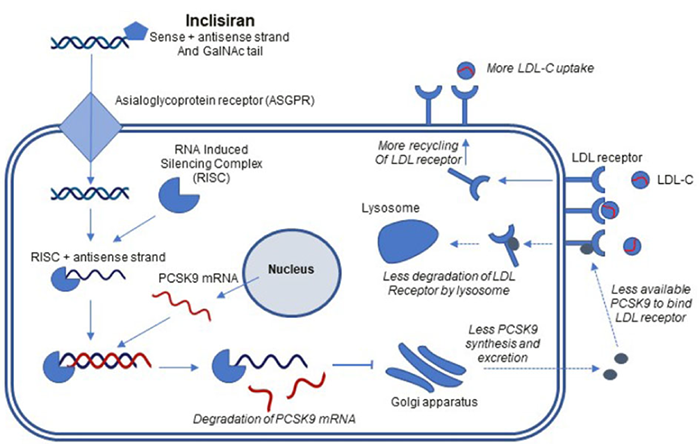
Inclisiran 作用機製[5]
ASO 療法 AZD8233
AZD8233 是一種靶向 PCSK9 的反義寡核苷酸 (ASO),可用於降低循環中的 LDL-C 水平。AZD8233 (ION-863633) 是由 AstraZeneca 和 Ionis 共同研發的。AZD8233 是一種化學修飾的 16 聚體反義寡核苷酸,與 N-乙酰半乳糖胺 (GalNAc) 相連,可有效靶向肝細胞中的 PCSK9 mRNA,防止 PCSK9 的合成。研究發現皮下給藥後,AZD8233 耐受性良好。AZD8233 治療高脂血症和血脂異常當前正處於 II 期臨床階段。
來自 Clinicaltrials官網
臨床試驗結果表明,單次皮下注射 AZD8233 (劑量範圍為 4 - 120 mg) 有效地降低了血漿中 PCSK9 蛋白和 LDL-C 濃度。血漿中 PCSK9 和 LDL-C 的最大平均降低幅度分別為 >90% 和 70%。在給藥後的 16 周內,PCSK9 和 LDL-C 水平緩慢恢複至基線或接近基線水平。
總結與展望
非編碼 RNA 已被證明具有重要的生理功能。非編碼 RNA 包括小 RNA 和長非編碼 RNA。MicroRNA 通過與靶 mRNA 的 3' 非翻譯區結合,在轉錄後調節基因表達,從而阻斷蛋白質翻譯或誘導其降解。長鏈非編碼 RNA 具有更多樣化的功能,可作為表觀遺傳調節劑、分子支架或誘餌。MicroRNA 和長鏈非編碼 RNA 有望成為治療心血管疾病的新靶點,如心力衰竭、急性心肌梗死、纖維化和動脈粥樣硬化。siRNA 是 RNA 雙鏈體,主要以與抗 miRNA 類似的方式進行化學修飾,以提高核酸酶穩定性和細胞攝取。例如,miR-181a 被 siRNA 下調,降低心肌梗死大鼠骨骼肌成肌細胞移植的致心律失常作用。當前小核酸藥物降低心血管疾病靶點效果顯著。已有多種針對心血管疾病的小核酸藥物處於臨床研究階段。
由於小核酸藥物監測的指標較多,生物分析方法呈現多樣化,既要用 LC-MS/MS 方法,又要用 ELISA 或 ECL 方法來進行綜合評價,所以建議生物分析方法難度高。另外,小核酸原料藥生產使用固相合成技術,在工藝開發、工藝放大和質量控製上存在較高壁壘,小核酸原料藥固相合成配套設備、潔淨環境等前期投入非常大,同時生產需符合 GMP要求。因此,國內有能力生產小核酸原料藥的企業較少。
hjc黄金城已經具備小核酸工藝質量研究能力,同時已在開發和建立完善的小核酸的分析方法。目前,hjc黄金城在 mRNA,siRNA 等小核酸藥物方麵的多個 FTE 項目以及 CMC 服務項目已啟動。歡迎前來了解hjc黄金城小核酸藥物藥物方麵的更多信息 (
marketing@yakkaa.com)!
相關推薦
參考文獻
[1]. Scott M Grundy, et al. 2018AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on theManagement of Blood Cholesterol: A Report of the American College ofCardiology/American Heart Association Task Force on Clinical PracticeGuidelines. Circulation. 2019 Jun 18;139(25):e1082-e1143.
[2]. Nabil G Seidah, et al. PCSK9: a key modulator ofcardiovascular health. Circ Res. 2014 Mar 14;114(6):1022-36.
[3]. Gregory G Schwartz, et al. Alirocumab and CardiovascularOutcomes after Acute Coronary Syndrome. N Engl J Med. 2018 Nov 29;379(22):2097-2107.
[4]. Marc S Sabatine, et al. Evolocumaband Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017 May 4;376(18):1713-1722.
[5]. Arjen J Cupido, et al. Inclisiranfor the treatment of hypercholesterolaemia: implications and unansweredquestions from the ORION trials. Cardiovasc Res. 2020 Sep 1;116(11):e136-e139.
[6]. Pratik Pandey, et al. PCSK9Inhibition and Atherosclerosis: Current Therapeutic Option and Prospection. MethodsMol Biol. 2020;2204:133-143.
[7]. Catarina Nilsson, et al. Abstract13913: Single Dose Safety, Pharmacokinetics, and Pharmacodynamics of aPotent PCSK9 Synthesis Inhibitor, AZD8233, in Subjects With Elevated LdlCholesterol.

聯係我們:
電話: +86 (21) 5859-1500(總機)




















 相關新聞
相關新聞