基因療法是當今最前沿的技術之一,在治療腫瘤、遺傳性疾病、代謝疾病,預防性傳染病等方麵不斷取得突破性進展。其中,小核酸藥物是目前發展最為迅猛的基因療法之一,正在成為新藥研發第三次浪潮中的佼佼者。
小核酸藥物簡介
小核酸藥物主要包括反義寡核苷酸 (ASO)、小幹擾RNA (siRNA)、微小RNA (miRNA)、小激活RNA (saRNA)、信使RNA (mRNA)、RNA適配 (Aptamer)等。
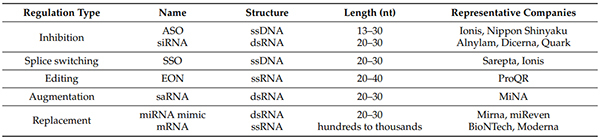
核酸藥物分類[1]
反義寡核苷酸 (ASO) 技術原理:ASO 分子量較小 (約 18-30 個核苷酸),是合成的單鏈核酸聚合物,可通過多種機製調節基因表達。ASO 調控基因表達的途徑有3種:第1種:ASO 與 mRNA 結合後,形成空間位阻,使 mRNA 不能再進入核糖體進行蛋白質翻譯,使得這種 mRNA 所攜帶的基因信息表達下調。第二種:ASO 通過堿基互補配對,與靶標 mRNA 結合後,招募 RNA 酶將 mRNA 降解,同樣使得基因表達下調。第三種:主要是針對 pre-mRNA 在形成 mRNA 的過程中,ASO 結合於 Pre-mRNA 的某個外顯子區域,使得這段外顯子被剪切掉,在最終生成的 mRNA 中不包含這段外顯子。
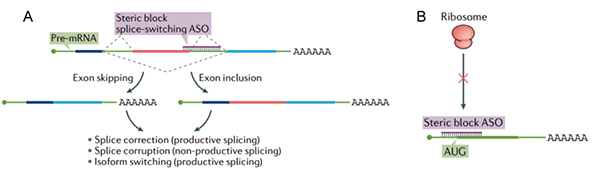
ASO作用機製[2]
RNA幹擾 (RNA interfering; RNAi) 技術原理:反義 RNA 與靶基因的 mRNA 以堿基互補配對的形式結合而導致的序列特異性基因沉默現象。長鏈雙 RNA (dsRNA) 被剪切為siRNA (小幹擾 RNA) 後,與蛋白質結合形成 siRNA 誘導幹擾複合體 (RISC),RISC再與互補的 mRNA (信使 RNA) 結合,使靶基因 mRNA 降解,最終沉默特定基因表達,從而實現對患者體內特定靶基因表達進行調控的基因治療。

RNAi作用機製[3]
小核酸藥物發展史
1978 年,哈佛大學科學家Paul Zamecnik 等人首次報道了反義寡核苷酸 (antisense oligodeoxynucleotides) 可抑製肉瘤病毒的複製;
1998 年,全球首款 ASO 藥物 (反義寡核苷酸藥物) Vitravene批準上市;
1998 年,Andrew Fire 和 Craig Mello 在線蟲中首次揭示了RNAi現象,並憑借這一發現於 2006 年獲得了諾貝爾生理學與醫學獎;
2001 年,RNAi 技術被 Science 雜誌評為 2001 年的十大科學進展之一;
2004 年,OPKO 公司用於老年性黃斑變病的第一個 siRNA 藥物 Bevasiranib 進入臨床試驗;
2005-2016 年,由於小核酸技術領域的技術瓶頸遲遲沒有獲得突破,藥物本身的特性以及商業化進程中的種種問題導致該領域進入了一段低穀期;
2016 年,SareptaTherapeutics 和 Ionis 研發的 2 款 ASO 藥物先後被 FDA 批準上市;
2018 年, 全球首款 siRNA 藥物即 Alnylam 公司的 Onpattro 由 FDA 批準上市,用於由 hATTR 引起的多發性神經病患者的治療;
目前,全球有超過 20 餘款 siRNA 藥物,50 餘款 ASO 藥物處於臨床研究階段,治療領域覆蓋中樞神經係統、心血管、抗感染和抗腫瘤等。
全球小核酸藥物發展現狀
國外小核酸藥物研發概況:目前全球上市的小核酸藥物共有 15 款,約 85% 是 2015 年以後上市。Ionis、Alnylam、Sarepta 是小核酸藥物領域的三巨頭。
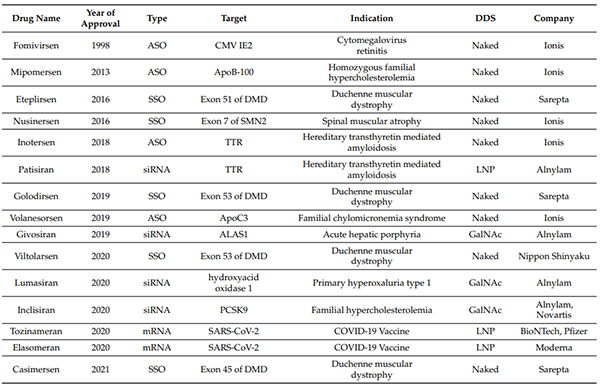
FDA/EMA批準的核酸藥物 (截至2021年6月30日)[1]
國內小核酸藥物研發概況:與國外相比,國內目前還暫無獲批的小核酸藥物,國內的小核酸藥企業目前都還處於發展初期或者上升期。國內企業中小核酸藥物的領先企業包括蘇州瑞博生物、蘇州聖諾製藥、中美瑞康等。
| 小核酸藥物領域 | 代表企業 |
| ASO | 瑞博生物等 |
| siRNA | 瑞博生物、聖諾製藥等 |
| saRNA | 中美瑞康等 |
圖:國內小核酸藥物研發代表企業
小核酸藥物特點及優勢
❖ 特異性強:小核酸藥物是根據目標RNA人工設計的,所以目標明確,靶點特異性強。
❖ 設計簡便、研發周期短:小核酸藥物臨床前研發首先通過測定基因序列,針對疾病基因進行合理設計,使基因靶向沉默,所以能避免盲目開發,很大程度上節省研發時間。
❖ 靶點豐富:小核酸藥物從轉錄後水平進行治療,能針對一些蛋白靶點能有療效的特殊靶點進行突破,有望攻克尚無藥物的遺傳疾病。
小核酸藥物開發挑戰和策略
小核酸藥物開發過程中最大的難題是避免快速被降解並進入靶向細胞發揮治療功能。目前國內外均有相當成熟的技術,隨著基因測序技術的發展,測序成本降低,為小核酸藥物產業化提供了可能。在小核酸藥物的開發過程中最大的難點是向患者注射小核酸藥物後,藥物如何在體內存留足夠長的時間、並精準進入靶向細胞發揮治療功能,同時最大程度的避免誤傷正常細胞。
核酸藥物遞送壁壘[4]
小核酸原料藥生產使用固相合成技術,在工藝開發、工藝放大和質量控製上存在較高壁壘,小核酸原料藥固相合成配套設備、潔淨環境等前期投入非常大,同時生產需符合 GMP要求。因此,國內有能力生產小核酸原料藥的企業較少,相關產業配套尚不完善,隨著市場需求的增加,能否保證小核酸藥物的及時供應成為產品開發和商業化成功的重要挑戰。目前,hjc黄金城在mRNA,siRNA等小核酸藥物方麵的多個FTE項目以及CMC服務項目已啟動。
小核酸藥物在體內不穩定,進入血液之後極易被核酸酶降解,且易通過腎髒清除,半衰期短,同時外源的核酸分子具有免疫原性,容易引起人體的免疫反應。此外,如果不能進入細胞實現胞吞,小核酸藥物將無法發揮作用。通過化學修飾和遞送係統可以解決這些問題。隨著技術突破,部分難題目前得到較好的解決辦法,其中化學修飾 (如:磷酸骨架、核糖、核糖五元環改造、堿基、核苷酸練末端改造等) 可以避免核酸藥物被核酸酶降解並延長半衰期,高效安全的遞送係統 (如:環糊精納米聚合物、脂質納米顆粒、綴合物遞送係統、乙酰半乳糖胺係統等) 可以使核酸藥物精準的靶向目標細胞並提高細胞攝取效率,使核酸藥物發揮治療功能。
小核酸藥物從轉錄後水平進行治療,能針對難以成藥的特殊蛋白靶點實現突破,有望攻克尚無藥物治療的疾病包括遺傳性疾病和其他難治性疾病。
小核酸藥物未來發展趨勢
未來,隨著小核酸藥物的應用領域和技術領域不斷突破創新,技術的更新將有助於小核酸藥物的發展。市場需求和市場規模將持續擴大,小核酸藥物的適應症範圍廣,包括腫瘤、罕見病、病毒性疾病、腎髒疾病、心血管疾病、炎症類疾病、代謝類疾病等。因此,小核酸藥物潛在適應人群基數大,隨著技術的發展和生產的成熟,小核酸藥物市場在未來將有更廣闊的發展空間。
小核酸藥物相比現有的小分子和抗體藥物具有靶點篩選快、研發成功率高、不易產生耐藥性、更廣泛的治療領域和長效性等優點,具有較大發展潛力。伴隨著技術的持續進步,小核酸藥物有望形成繼小分子藥物、抗體之後的現代新藥第三次浪潮。
參考文獻
[1] Yoji Yamada.NucleicAcid Drugs-Current Status, Issues, and Expectations for Exosomes. Cancers(Basel). 2021 Oct5;13(19):5002.
[2] Thomas C Roberts, et al. Advances in oligonucleotidedrug delivery. Nat Rev Drug Discov. 2020. Oct;19(10):673-694.
[3] David Bumcrot, et al. RNAi therapeutics: a potential new class of pharmaceutical drugs. Nat Chem Biol. 2006 Dec;2(12):711-9.
[4] Xuyu Tan, etal. Nucleic acid-based drug delivery strategies. JControl Release. 2020 Jul 10;323:240-252.


















