一、ELISA的基本原理
ELISA的基礎是抗原或抗體的固相化及抗原及抗體的酶標記。結合在固相載體表麵的抗原或抗體仍保持其免疫學活性,酶標記的抗原或抗體既保留其免疫學活性,又保留酶的活性。在測定時,受檢標本(測定其中的抗體或抗原)與固相載體表麵的抗原或者抗體起反應。用洗滌的方法使固相載體上形成的抗原抗體複合物與液體中的其它物質分開。再加入酶標記的抗原或抗體,也通過反應而結合在固相載體上。此時固相載體上的酶量與標本中受檢物質的量呈一定的比例。加入酶反應的底物後,底物被酶催化為有色產物,產物的量與受檢物質的量直接相關,因此可以根據呈色的深淺進行定性或定量分析。由於酶的催化效率很高,間接地放大了免疫反應的結果,使測定方法達到很高的敏感度。
ELISA的基本原理有三條:
(1)抗原或抗體能以物理性地吸附於固相載體表麵,可能是蛋白和聚苯乙烯表麵間的疏水性部分相互吸附,並保持其免疫學活性;
(2)抗原或抗體可通過共價鍵與酶連接形成酶結合物,而此種酶結合物仍能保持其免疫學和酶學活性;
(3)酶結合物與相應抗原或抗體結合後,可根據加入底物的顏色反應來判定是否有免疫反應的存在,而且顏色反應的深淺是與標本中相應抗原或抗體的量成正比例的,因此,可以按底物顯色的程度顯示試驗結果。
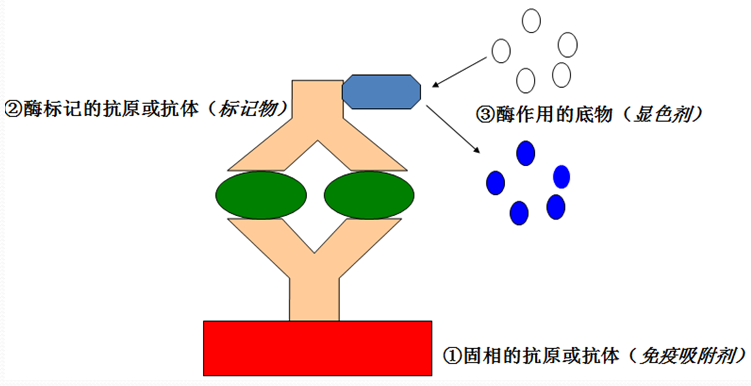
二、抗原和抗體
1.抗原是能在機體中引起特異性免疫應答的物質。抗原進入機體後,可刺激機體產生抗體和引起細胞免疫。
2.抗體是能與抗原特異性結合的免疫球蛋白(Ig)。Ig分五類,即IgG、IgA、IgM、IgD和IgE。與免疫測定有關的Ig主要為IgG和IgM。
三、ELISA的種類
1.直接法
直接法隻能用來測定抗原 :
①. 將抗原與固相載體連接,洗滌除去未結合的抗原及雜質。
②.加酶標抗體,保溫反應。固相免疫複合物上的抗原與酶標抗體結合。徹底洗滌未結合的酶標抗體。此時固相上帶有的酶量與標本中受檢抗原的量相關。
③.加底物反應。固相上的酶催化底物成為有色產物,此時底物的降解量=抗原量。
2.雙抗夾心法
雙抗夾心法,此法適用於測定二價或二價以上的大分子,但不適用於測半抗原抗體及小分子單價抗原抗體,此法既可以測抗體又可以測抗原:
測抗原的原理:
①.將特異性抗體與固相載體連接,形成固相抗體。洗滌除去未結合的抗體及雜質。
②.加受檢標本,保溫反應。標本中的抗原與固相抗體結合,形成固相抗原抗體複合物。洗滌除去其它未結合物質。
③.加酶標抗體,保溫反應。固相免疫複合物上的抗原與酶標抗體結合。徹底洗滌未結合的酶標抗體。此時固相上帶有的酶量與標本中受檢抗原的量相關。
④.加底物反應。固相上的酶催化底物成為有色產物。通過比色,測知標本中抗原的量。
雙抗夾心法測抗體的反應模式與測抗原類似,用特異性抗原進行包被和製備酶結合物,以檢測相應的抗體。
3.間接法
原理:利用酶標記的抗抗體(抗人免疫球蛋白抗體)以檢測與固相抗原結合的受檢抗體。
操作步驟:
①.將特異性抗原與固相載體連結,形成固相抗原。洗滌除去未結合的抗原及雜質。
②.加稀釋的受檢血清,保溫反應。血清中的特異抗體與固相抗原結合,形成固相抗原抗體複合物。經洗滌後,固相載體上隻留下特異性抗體,血清中的其它成份在洗滌過程中被洗去。
③.加酶標抗體。固相免疫複合物中的抗體與酶標抗抗體結合,從而間接地標記上酶。洗滌後,固相載體上的酶量與標本中受檢抗體的量正相關。
④.加底物顯色。
4.競爭法
原理:標本中的抗體(抗原)和一定量的酶標抗體(抗原)競爭與固相抗原(抗體)結合。標本中抗體(抗原)量越多,結合在固相上的酶標抗體(抗原)愈少,因此陽性反應呈色淺於陰性反應。
四、實驗操作步驟
1. 包被抗原:用包被液將抗原作適當稀釋, 一般為1~10微克/孔,每孔加200微升,37℃溫育1小時後,4℃冰箱放置16~18小時。
2. 洗滌:倒盡板孔中液體,加滿洗滌液,靜放三分鍾,反複三次,最後將反應板倒置在吸水紙上,使孔中洗滌液流盡。
3. 加封閉液200微升,37℃放置一小時。
4. 洗滌同2。
5. 加被檢血清:用稀釋液將被檢血清作幾種稀釋,,每孔200微升。同時作稀釋液對照。37℃放置2小時。
6. 洗滌同2。
7. 加辣根過氧化物酶羊抗兔IgG, 每孔200微升, 放置37℃ 1小時。
8. 洗滌同2。
9. 加底物:鄰苯二胺溶液加200ml,室溫暗處10--15分鍾。
10. 加終止液:每孔50微升。
11. 觀察結果:用酶聯免疫檢測儀記錄490nm讀數。
五、實驗注意事項
1.正式實驗時,應分別以陽性對照與陰性對照控製實驗條件,待檢樣品應作一式二份,以保證實驗結果的準確性。有時本底較高,說明有非特異性反應,可采用羊血清、兔血清或BSA等封閉。
2.在ELISA中,進行各項實驗條件的選擇是很重要的,包括
(1)固相載體的選擇:
許多物質可作為固相載體,如聚氯乙烯、聚苯乙烯、聚丙酰胺和纖維素等。其形式可以是凹孔平板、試管等。目前常用的是96孔聚苯乙烯凹孔板。不管何種載體,在使用前均可進行篩選:用等量抗原包被,在同一實驗條件下進行反應,觀察其顯色反應是否均一性,據此判明其吸附性能是否良好。
(2)包被抗體(或抗原)的選擇:
將抗體(或抗原)吸附在固相載體表麵時,要求純度要好,吸附時一般要求PH在9.0~9.6之間。吸附溫度,時間及其蛋白量也有一定影響,一般多采用4℃18~24小時。蛋白質包被的最適濃度需進行滴定:即用不同的蛋白質濃度(0.1、1.0和10μg/ml等)進行包被後,在其它試驗條件相同時,觀察陽性標本的OD值。選擇OD值最大而蛋白量最少的濃度。對於多數蛋白質來說通常為1~10μg/ml。
(3)酶標記抗體工作濃度的選擇:
首先用直接ELISA法進行初步效價的滴定。然後再固定其它條件或采取“方陣法”(包被物、待檢樣品的參考品及酶標記抗體分別為不同的稀釋度)在正式實驗係統裏準確地滴定其工作濃度。
(4)酶的底物及供氫體的選擇:
對供氫體的選擇要求是價廉、安全、有明顯地顯色反應,而本身無色。有些供氫體(如OPD等)有潛在的致癌作用,應注意防護。有條件者應使用不致癌、靈敏度高的供氫體,如TMB和ABTS是目前較為滿意的供氫體。底物作用一段時間後,應加入強酸或強堿以終止反應。通常底物作用時間,以10-30分鍾為宜。底物使用液必須新鮮配製,尤其是H2O2臨用前加入。
(5)樣品:
通過查文獻或預實驗大概確定標本中樣品含量,再對樣品進行稀釋,加樣。
六、ELISA的特點
特點一:靈敏性
該測定法的靈敏度來自作為報告基團的酶。眾所周知, 酶是一種有機催化劑,很少量的酶即可誘導大量的催化反應 ,產生可供觀察的顯色反應現象。因此該體係常被稱為酶放大體係。ELISA實現了在細胞或亞細胞水平上示蹤抗原或抗體的所在部位,或在微克、甚至納克水平上對其進行定量。
例如,在測定血清中某一物質的含量時,化學比色法的敏感度為mg/ml水平,酶反應測定法的敏感度約為5~10μg/ml 。
特點二:特異性
其特異性來自抗體或抗原的選擇性。抗原抗體的結合實質上隻發生在抗原的抗原決定簇與抗體的抗原結合位點之間。由於兩者在化學結構和空間構型上呈互補關係,所以抗原抗體反應具有高度的特異性。
如何正確的進行elisa測定操作步驟
臨床ELISA測定現通常為采用手工操作的以微孔板條為固相的測定模式,測定操作非常簡單,一般涉及到標本的收集保存、試劑準備、加樣、溫育、洗板、顯色、比色、結果判斷和結果報告及解釋等方麵,其中任一步驟的不當都會影響測定結果,且尤以加樣、溫育和洗板等步驟為甚。現分述如下。
臨床標本的收集和保存
用於ELISA測定的臨床標本最為常用的是血清(漿),有時因為特定的檢測目的,也用到唾液、腦脊液、尿液、糞便等標本。目前臨床上使用血清標本測定的標誌物一般有傳染性病原體的抗原和抗體、腫瘤標誌物、激素、特種蛋白、細胞因子和治療藥物等。對用於激素和治療藥物測定的血清標本的收集,要注意收集時間甚或體位有可能會對測定結果產生影響。如可的鬆在早晨4~6點之間,會有一峰值出現:生長激素、促黃體激素(LH)和促卵泡激素(FSH)均以陣發性方式釋放,因此,在測定此類激素時,有必要在密切相連的時間間隔內采取數份血樣本,以其中間值為測定值。又如當從臥位變為站立位時,血清中腎素活性將出現明顯增高。再如治療藥物的檢測,應根據藥代動力學選擇服藥後的最適時間抽血檢測。用於傳染性病原體的抗原和抗體、腫瘤標誌物和特種蛋白等的檢測的血清標本的收集則沒有時間和體位方麵的影響,隻是在處理和保存方麵要考慮以下幾個方麵。
(1)要注意避免出現嚴重溶血。血紅蛋白中含有血紅素基團,其有類似過氧化物的活性,因此,在以HRP為標記酶的ELISA測定中,如血清標本中血紅蛋白濃度較高,則其就很容易在溫育過程中吸附於固相,從而與後麵加入的HRP底物反應顯色。
(2)樣本的采集及血清分離中要注意盡量避免細菌汙染,一則細菌的生長,其所分泌的一些酶可能會對抗原抗體等蛋白產生分解作用;二則一些細菌的內源性酶如大腸杆菌的β-半乳糖苷酶本身會對用相應酶作標記的測定方法產生非特異性幹擾。
(3)血清標本如是以無菌操作分離,則可以在2~8℃下保存一周,如為有菌操作,則建議冰凍保存。樣本的長時間保存,應在-70℃以下。
(4)冰凍保存的血清標本須注意避免因停電等造成的反複凍融。標本的反複凍融所產生的機械剪切力將對標本中的蛋白等分子產生破壞作用,從而引起假陰性結果。此外,凍融標本的混勻亦應注意,不要進行劇烈振蕩,反複顛倒混勻即可。
(5)標本在保存中如出現細菌汙染所致的混濁或絮狀物時,應離心沉澱後取上清檢測。
試劑準備
在臨床實驗室,對試劑準備一般不太注意,通常的做法是,在實驗時將試劑從冰箱中拿出來即用,而忽略了這種做法有可能影響後麵溫育時間不夠的問題,其直接的後果是對一些弱陽性標本的檢測出現假陰性。因此在ELISA測定中試劑的準備最為關鍵的是,在實驗開始前,將試劑盒先從冰箱中拿出來,在室溫下放置20分鍾以上後,再進行測定,以使試劑盒在使用前與室溫平衡。這樣做的目的,主要是為了在後麵的溫育反應步驟中,能使反應微孔內的溫度能較快地達到所要求的高度,以滿足測定要求。其次,目前的商品ELISA試劑盒中的洗板液均需在實驗室使用時對所提供的濃縮液稀釋配製,因此稀釋時所用的蒸餾水或去離子水應保證質量。此外,當試劑盒以OPD為底物時,則底物溶液應在反應顯色前臨時配製。
加血清樣本及反應試劑
在現在的ELISA商品試劑盒中,血清樣本的加入幾乎是唯一的要使用微量加樣器加入樣本的步驟。使用微量加樣器加樣必須注意的關鍵點是:加樣不可太快,要避免加在孔壁上部,不可濺出和產生氣泡。加樣太快,無法保證微量加樣的準確性和均一性。加在孔壁上部的非包被區,易導致非特異吸附。濺出會對鄰近孔產生汙染。出現氣泡則反應液界麵有差異。試劑的加入在國產試劑盒中基本上均是從滴瓶中滴加,除了要注意滴加的角度外,滴加的速度也很重要,滴加太快,很容易出現重複滴加或加在兩孔之間的現象,這樣就會在孔內的非包被區出現非特異吸附,從而引起非特異顯色。所以,有時候一份標本用相同的試劑盒這次測定為陽性,下次測定為陰性,往往就是上述加樣及試劑的錯誤所致。
溫育
溫育是ELISA測定中影響測定成敗最為關鍵的一個因素。ELISA作為一種固相免疫測定,抗原抗體的結合反應在固相上進行,要使液相中的抗原或抗體與固相上的特異抗體或抗原完全結合,必須在一定的溫度條件下反應一定的時間。溫育所需時間與溫度成反比,即溫度越高,則所需時間相對較短。最為常用的溫育溫度有37℃和室溫,其次是43℃和2~8℃。
溫育這一步是臨床ELISA測定中最容易出現問題的步驟。通常目前國內ELISA商品試劑盒的反應溫育時間為37℃ 30分鍾~1小時,進口ELISA試劑盒則通常為37℃ 1~2小時才能有較完全的結合,低於1小時,可能會影響測定下限。因此,關於溫育,在實際測定操作中一定要注意以下幾點:
(1)要保證在設定的溫度下有足夠的反應時間。一般來說,加完樣本和/或反應試劑後,將微孔板從室溫拿至水浴箱或溫箱中時,孔內溫度從室溫升至37℃,需要一定的時間,尤其是在室溫比較低以及非水浴的狀態下,這段升溫時間可能還比較長,而在臨床實驗室中,很少有人注意這個問題,通常是將微孔板一放入溫箱即開始計時,這樣就很容易造成實際測定中溫育時間不夠,弱陽性樣本測不出來的問題。曾有一地處南方的血站同行提出了一個問題,就是在每一年的冬季總有那麽一個多月的時間,在做HBsAg測定的室內質控中,測定由衛生部臨床檢驗中心供應的1 ng/ml弱陽性樣本時,總是測不出來,不知原因為何?這可能就與南方冬天室內溫度較低有關,此時微孔板轉入溫箱後37℃溫育時間不夠,以致弱陽性樣本測定為陰性。因此,為保證37℃下足夠的溫育時間,臨床實驗室可自行確定本實驗室不同季節(不同室溫下)微孔板從室溫拿至溫箱後需要多長時間孔內溫度才能達到37℃,從而適當延長板條在溫箱中的放置時間。具體的做法是,用一小溫度計放置板孔反應溶液中測量觀察即可。
聯係我們
郵箱:marketing@yakkaa.com
電話:02158591500
以上是關於elisa實驗服務,elisa方法檢測,酶聯免疫吸附試驗的內容,來源於hjc黄金城官網。
相關內容推薦















