
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




類器官技術:利用幹細胞直接誘導生成三維組織模型,為人類生物學研究提供了強大的方法支持,目前對於這種工具的研究正在不斷發展進步中。
尤其是近年來隨著基因療法和細胞療法的火爆,類器官的研究也如火如荼。
hjc黄金城已經建立了完善的基於動物疾病模型的藥效學研究平台 (包括PDX模型、異種腫瘤移植模型、人源化腫瘤移植模型等),同時不斷為創新療法賦能,全麵布局腫瘤免疫療法的評價和研究,已完成 CAR-T,CAR-NK,溶瘤病毒,抗體,siRNA,AAV等免疫療法的模型建立及藥效評價。hjc黄金城還將布局類器官的藥效學研究平台!

類器官發展史[1]
雖然同傳統的體外/體內模型相比,類器官具有諸多優勢,但傳統類器官培養平台尚有一些技術難題待解決,如無法構建免疫微環境模型、不能再現血管化過程以及難以實現多器官互作等;其次傳統平台難以實現類器官培養體係的標準化,因而模型重現性和穩定性低,大規模和自動化應用目前難以實現。
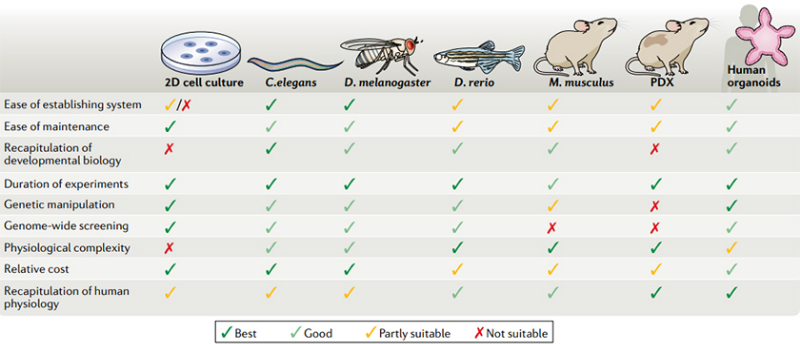
類器官與其他模型係統的比較[2]

類器官的應用[2]
[1]Toshiro Sato, et al. Single Lgr5 stemcells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 2009 May 14;459(7244):262-5.
[2] Jihoon Kim, et al. Human organoids: model systems for human biology and medicine. Nat Rev Mol Cell Biol. 2020 Oct;21(10):571-584.
[3] Nick Barker, et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature. 2007 Oct 25;449(7165):1003-7.
[4] Hans Clevers. Modeling Development and Disease with Organoids. Cell. 2016 Jun 16;165(7):1586-1597.
[5] Claudia Corrò, et al. A brief history of organoids. Am J Physiol Cell Physiol. 2020 Jul 1;319(1):C151-C165.