中國上市公司研究院
近日,一個醫藥自媒體發了篇文章:“八方結網、十麵埋伏,2018年3000家藥企要倒閉!”今年會不會有3000家藥企倒閉,我們不好判斷,但5年內醫藥工業將完成行業重構則是大概率事件。
在剛剛過去的2017年,醫藥行業出台了較多的政策,其中,醫保支付、一致性評價和優先審評、創新藥的對外開放等政策將深遠地影響行業,目的在於提高行業集中度。未來,那些實力雄厚、緊隨政策走向、創新藥研發能力強的醫藥集團和在生物製劑等新領域率先突破的企業將取勝於市場。屆時,中國醫藥行業的格局將是“醫藥集團+創新型企業”的模式。
萬億市場大重構
1月19日,國家藥監局發布《關於進一步加強食品藥品標準工作的指導意見》,製訂修訂國家藥品標準3050個,以加快藥品標準提檔升級,保障藥品安全有效。這是國家藥監局為提升中國藥品質量使出的又一重拳。
目前,國家藥監局在重點實施的一項工作是一致性評價。所謂的一致性評價是指仿製藥品在質量和療效上達到與原研藥品一致的水平,最早是2012年國務院在《國家藥品安全“十二五”規劃》中提出的。2016年3月5日,國務院辦公廳印發了《關於開展仿製藥質量和療效一致性評價的意見》。最初納入一致性評價的是289個基藥目錄品種中的口服藥片,2017年12月22日,國家藥監局又公開征求《已上市化學仿製藥(注射劑)一致性評價技術要求》意見;目前我國臨床使用的西藥超過70%是注射劑型,相對於口服固體製劑而言,注射劑的覆蓋範圍更廣,終端金額更大,相關企業更多,對於行業的影響超過口服藥品的一致性評價。下一步,將對中藥注射劑進行一致性評價。
為推動一致性評價工作,國務院及其相關主管機構出台了相應的政策,核心是兩點:一是對通過一致性評價的藥品,在醫保支付方麵給予適當支持,醫療機構應優先采購並在臨床中優先選用;二是同品種藥品通過一致性評價的生產企業達到3家以上,在藥品集中采購等方麵不再選用未通過一致性評價的品種。國家基本藥物目錄(2012年版)中2007年10月1日前批準上市的化學藥品仿製藥口服固體製劑,應在2018年底前完成一致性評價,其中需開展臨床有效性試驗和存在特殊情形的品種,應在2021年底前完成一致性評價;逾期未完成的,不予再注冊。
去年12月,國家藥監局聯合衛計委等部門發布通知,再次明確了通過一致性評價的藥品要優先采購、優先使用;今年1月,上海帶量采購藥品時率先實施。
目前,一致性評價進度遠超預期,並將在今年步入一致性評價收獲期。2017年底,國家藥監局公布了首批包含氯吡格雷(信立泰(40.990, -0.52, -1.25%))、厄貝沙坦(華海藥業(28.390, 0.85, 3.09%)、海正藥業(15.070, -0.43, -2.77%))等在內的17個品規12個品種通過一致性評價名單。截至目前,2017年11月之前報審的品種已全部審評完畢,平均審評時間在60天-120天。從此次審評過程可看出,國家藥監局對仿製藥一致性評價審評之嚴、效率之高。
仿製藥一致性評價是對仿製藥行業的重新洗牌,質量水平不達標的仿製藥品將退出市場;國家藥品標準的修訂可看作是這一政策的延續,將加劇醫藥行業的洗牌。國家藥品標準的修訂就是要建立藥品標準淘汰機製,加大對已取消文號、質量不可控、穩定性不高的藥品標準的淘汰力度。
據中康資訊的數據,2016年,中國藥品終端市場(不含藥材)總規模達14909億元。據測算,一致性評價和國家藥品標準修訂將涉及1萬億市場的洗牌。
國內創新藥將迎來紅利
2016年2月26日,國家藥監局發布了《關於解決藥品注冊申請積壓實行優先審評審批的意見》,2017年12月28日,又發布了《總局關於鼓勵藥品創新實行優先審評審批的意見》,兩個政策之間出現了重大的變化,優先審評審批的導向目標由解決藥品注冊申請積壓改為了鼓勵藥品創新。在剛剛過去的2017年,國家藥監局對臨床急需的創新藥審批非常快,如阿斯利康旗下的奧希替尼(腫瘤治療藥品)在美國上市的時間是2015年11月,該藥品在我國申請後,短短幾個月就被批準上市。
最近十年,大量海外華人醫藥科學家回國,恒瑞醫藥(76.080, -0.31, -0.41%)、麗珠集團(77.180, -0.82, -1.05%)、科倫藥業(25.870, -0.03, -0.12%)等一批醫藥上市公司在新藥研發上投入重金,研發投入在公司營收中的占比也越來越高;同時,國內企業跟進布局前沿靶點的能力越來越強,甚至個別領域已經能夠與歐美先進水平一較高下,申報的新藥數量呈井噴之勢。一個方麵的體現是,國外生物醫藥公司引進中國藥企自主研發創新藥的海外權益的案例越來越多見,交易規模也越來越高。和記黃埔醫藥的沃利替尼和呋喹替尼分別賣給阿斯利康、禮來,並與他們進行全球共同研發;百濟神州、信達生物、恒瑞醫藥、譽衡藥業(6.740, -0.06, -0.88%)、康方生物、正大天晴等都有類似的案例。但在2017年批準的12個重磅新藥中並沒有中國企業的份,中國藥企的創新之路才剛剛開始。
2017年10月8日,中央發布《關於深化審評審批製度改革鼓勵藥品醫療器械創新的意見》。這個文件被醫藥行業認為是劃時代和裏程碑式的文件,因為其主旨發生了變化,不再以自我為中心,而是要向國際最先進質量水平看齊。因此,我們看到,在國家藥監局公布的優先審評名單中有著眾多的國外藥企的創新性藥品。
在優先審評政策之下,2017年有20家左右的外企新藥獲批在國內上市,包括拜耳、諾華、賽諾菲、強生、阿斯利康等跨國公司。這些新藥治療領域包括丙肝、糖尿病、帕金森病、艾滋病、高血壓、抑鬱症等。不過今年情況會有所改變,前沿生物、恒瑞醫藥、正大天晴、和黃醫藥等都有新藥或將獲批上市。目前新申報的國產新藥臨床試驗數量已經達到300個以上,這些申報的品種預計將於3-5年後逐步獲批上市。所以,目前來看,優先審評更利好外企,但三五年後國內藥企將全麵享受政策紅利。
不過,從申報和在研情況來看,重複性較高,有的靶點研發數量達到幾十個,既會造成研發風險高,也會嚴重影響創新藥未來的收益。
醫改推動行業洗牌
目前,我國醫保支付方式改革方向已基本確立,即通過總額預付、按病種付費等混合支付方式控製總體醫保支出增長;同時通過價格談判將臨床急需、創新程度高的藥品納入報銷範圍,解決部分重大疾病患者的就醫問題;對輔助用藥等品種報銷比例減少甚至取消,節省的醫保資金更多地用於有治療效果的創新藥、高品質仿製藥上。
2017年底,各地加快了醫保支付改革,逐步推行以按病種付費為主的多元複合式醫保支付方式。據不完全統計,全國近三分之二的省份已經實施或正試點實施按病種收費。
按病種收費,即從患者入院起,按病種治療管理流程接受規範化診療,達到臨床療效標準後出院,整個過程中發生的診斷、治療、手術等各項費用,都一次性打包收費。按病種收費主要針對的是檢查和檢驗費用、藥品和耗材費用。通過減少過度的檢查和檢驗費用與不必要的藥品和耗材費用,達到控製醫療費用的目的。
打包收付費方式下,病人使用的藥品、醫用耗材和檢查檢驗都成為診療服務的成本,而不是醫院獲得收益的手段。這樣,醫生不再亂開藥,隻會用臨床價值高、性價比好的藥,醫院用藥理念的轉變將推動醫藥行業洗牌,利好相對進口產品價格較低的國產優質仿製藥企業。
細胞治療有望趕超
醫藥行業資深人士認為,中國藥企有兩條路可走,一是堅定不移地走國際化之路,重點在化學藥品製劑;二是堅定不移地走創新驅動之路,重點在生物製劑。
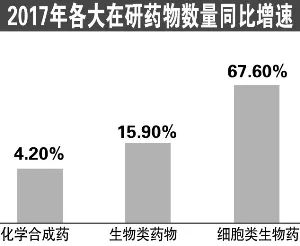
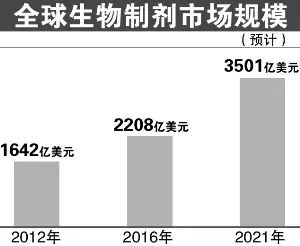
2016年全球十大暢銷藥物中有8款為生物製劑,全球生物製劑市場由2012年的1642億美元增長至2016年的2208億美元,複合增長率約為7.7%,預計2021年將增長至3501億美元,增速遠超過非生物製劑市場。2017年,前十大在研藥物中,增速最快的是細胞類生物在研藥,增速為67.6%。
從數據上來看,未來中國藥企最有希望取得突破的領域是生物製劑。從國內藥企臨床成功率來看,生物藥約為42.9%,化學藥約為27.6%,因此,生物製劑也容易取得成功。
目前,不僅藥企,資金也對研發生物製劑熱情較高。據不完全統計,2017年國內已有28家醫藥生物公司獲得投資,總金額超過9.3億美元。
在生物製劑領域,中國最有可能趕上國際步伐的是細胞治療領域,一是免疫細胞治療,二是幹細胞治療。2017年12月以來,國家藥監局已受理了6家企業免疫細胞治療中的CAR-T細胞治療,而對幹細胞藥物領域可能還不是很了解。
據美國臨床試驗數據庫(clinicaltrials.gov)網站登記的數據,目前全球至少有6377項幹細胞臨床研究正在開展中;截至去年11月28日,國內已有114家幹細胞臨床研究備案機構,相比2016年增加了70多家,這意味著我國幹細胞臨床研究正在加速發展。中商產業研究院發布的《2017-2022年中國幹細胞產業前景調查及投資機會研究報告》預計,2018年中國幹細胞產業規模將逼近1000億元。
在幹細胞領域,我國是排在全球第一陣營的,以俞君英博士領導的中盛溯源為代表。俞君英博士是人類誘導多能幹細胞iPSC的發明者之一,其合作夥伴於2012年被授予諾貝爾生理學或醫學獎。中盛溯源通過尋找與中國人群HLA配型比例最高的前200位純合子個體,製備iPSC細胞係,從而能較好地匹配中國大部分人群。也就是說,幹細胞可以工廠化批量生產,從而開創幹細胞普適性治療,並節省大量的時間和成本。目前,中盛溯源重點在攻克從iPSC規模化生產中腦DA神經元的技術從而治療帕金森病,正在準備開展臨床I期和II期試驗。
那些擁有一致性評價領先優勢和在生物製劑,特別是細胞治療領域率先取得突破的公司將在行業大洗牌中取勝。像信達生物、康方生物、中盛溯源未來有可能成為千億市值的公司。
或許,再過一年,或兩年,我們就能真正看清那些公司將在行業洗牌中獲勝,但我們相信目前市值千億俱樂部的名單必將發生變化。
















 相關新聞
相關新聞