世界衛生組織(World Health Organization,WHO)是聯合國下屬的一個機構,其宗旨是使全世界人民獲得盡可能高水平的健康。WHO的主要職能包括:促進流行病和地方病的防治;提供和改進公共衛生、疾病醫療和有關事項的教學與訓練;推動確定生物製品的國際標準。
在流行病爆發、自然災害國際救援、落後國家人道主義援助等情況下都會有WHO工作人員的身影,他們最重要的職責之一是協調各方資源進行醫療救助,挽救生命。在這過程中,藥品是必不可少的重要物資。但何種質量的藥品是符合WHO工作要求的呢?由於經濟實力、衛生條件和監管能力的差別,發達國家批準的藥品不一定適合落後國家,加上藥品監管屬於一種國家的主權範圍,WHO意識到必須建立一套自己的藥品監管係統便於自身在國際行動中發揮更大作用。
為了應對艾滋病在全球範圍內的爆發,WHO在2001年建立了藥品預認證製度Prequalification Team: medicines (PQTm),現已更名為Prequalification of Medicines Programme),拉開了WHO獨立審評審批藥品的序幕,隨後又陸續增加了流感、肝炎、瘧疾、結核病、生殖健康、兒童營養、腹瀉和其他易忽略的熱帶疾病等領域的基本用藥,隻有上述領域的藥品基於疾病流行、療效安全性證據以及性價比評估才會進入預認證邀請名錄中,並不是所有藥品都可以申請WHO預認證。認證範圍包括製劑、原料藥和獨立質檢實驗室。這樣一來可以基本滿足WHO日常國際行動中的普遍需求。
雖然WHO建立了獨立的藥品審評審批體係,但還是認可發達國家藥監部門批準的藥品,WHO將這些部門稱為Stringent Regulatory ity(SRA)。經SRA批準的藥品,經過簡略審評就可以進入WHO藥品預認證名錄。
一旦獲得WHO藥品預認證,藥企就可以進入WHO體係國際采購供應商名錄。此外,很多國際性非政府公益組織也認可WHO預認證製度,采購認證藥品用於人道主義捐贈。這對於藥企來說,可謂名利雙收。當然,由於這些藥品都屬於基本用藥且是公益性質,所以利潤相對而言不會太多,但采購量巨大,依然可以獲得不小收益。2016年桂林南藥兩個WHO預認證產品注射用青蒿琥酯銷售收入突破2億元,而鹽酸阿莫地喹+磺胺多辛乙胺嘧啶片銷售收入同樣過億元,是國內藥企經營WHO市場的佼佼者。
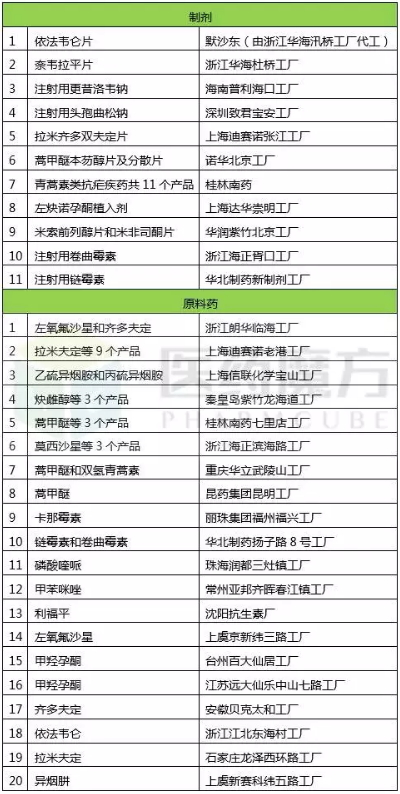
截止2017年8月31日,中國藥廠獲得WHO藥品預認證的品種如下:
反觀印度藥廠,通過WHO預認證的製劑有20多家,共300多個產品,遠超中國;而印度藥廠原料藥約有20家,共約60個產品,也不遜色於中國。
或許很多人都覺得WHO需要的都是老得掉渣的普藥,雖然量大,但畢竟利潤低,累死累活,賺不了大錢,不值得參與。不過,WHO審時度勢,與時俱進,最近盯上了抗體藥物。為了能夠讓最昂貴的癌症療法在中低收入國家得到更廣泛應用,WHO於2017年9月正式啟動預認證生物類似物藥品(WHO稱之為Similar Biotherapeutic Products,SBP)試點工作,包括用於治療非霍奇金淋巴瘤和慢性淋巴細胞白血病的利妥昔單抗和治療乳腺癌的曲妥珠單抗。這兩個藥品也已經收錄在WHO基本藥物目錄中。
申請WHO預認證的廠家根據藥品批準情況分成兩類:被SRA批準上市的藥品;被其他國家藥監局(National Regulatory ity,NRA)批準上市的藥品。
從中可以讀出兩個重要信息,首先SRA和NRA是有區別的,至於區別是啥,請接著往下看;第二點就是必須是已經批準的藥品,這不僅是因為WHO需要NRA的支持,減少工作量和降低風險,也是為了出口手續的必要性。當然,WHO也樂意與NRA開展合作,鼓勵有意願申請WHO藥品預認證的藥廠也向NRA做出說明,並請求NRA就質量評估過程與WHO合作。同時WHO也建議申請者也允許NRA就技術審評和現場核查與WHO工作人員進行討論。
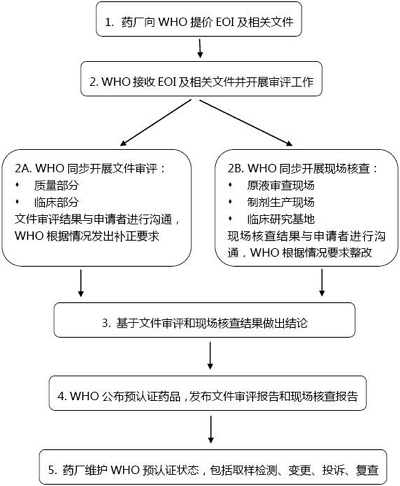
預認證流程通常包括:
1、WHO向工廠發出邀請(Invitation to Manufacturers);
2、藥廠根據邀請書要求提交意向文件(Expression Of Interest,EOI),包括1)申請函(Covering Letter);2)CTD格式產品文件(Product Dossier in Common Technical Document format);3)工廠主文件(Site Master File,SMF);4)合同研究組織主文件(Contract Research Organization Master File,CROMF);
3、WHO對申請文件進行形式審查,如果發現文件缺失,會通知申請者在規定時間內補齊,否則退回申請;如果文件齊全,WHO會發出信函告知文件參考號(dossier reference number),相當於受理號;
4、WHO開展文件審核,主要依據兩份WHO指導原則(WHO Guidelines onevaluation of similar Biotherapeutic Products (SBPs), Annex 2, Technical ReportSeries No. 977, 2009和WHO Guidelineson evaluation of monoclonal antibodies as similar biotherapeutic products(SBPs), Annex 2, Technical Report Series No. 1004, 2016);WHO希望有NRA代表參與這一過程;
5、WHO依據GMP、GLP、GCP和WHO建立的SOP,以及質量風險管理原則,對原液和製劑生產現場以及臨床試驗基地或CRO開展現場核查;WHO希望有NRA代表參與這一過程;
6、WHO將所有評估結果進行匯總,經討論後作出最終結論;獲得預認證的藥品將在WHO網站公布;
7、申請者維護預認證狀態:任何可能影響藥品療效、安全性和質量的生產工藝或質量控製變更都應當向WHO提交報告;向WHO提交藥物警戒計劃;按照WHO要求開展投訴調查;原液生產現場三年複查。
WHO生物類似物藥品預認證流程
如果滿足下列條件,生產現場或臨床研究基地可以免於檢查:
1、SRA已經核查過
2、最近核查發生在過去三年內
3、WHO可以獲得核查信息,包括核查報告和整改報告
4、基於上述信息,WHO認為現場符合WHO推薦的標準。
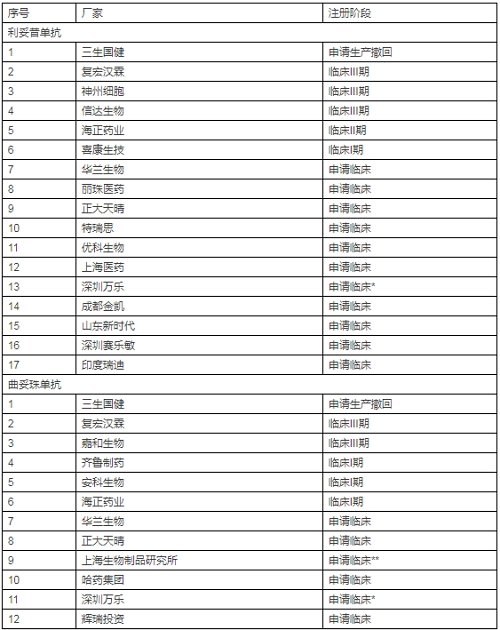
這裏就體現了SRA批準產品相比NRA批準產品的優勢了。不過目前SRA批準的產品還不多,隻有EMA批準了Sandoz和Celltrion的利妥昔單抗類似物。但有一些在注冊申請階段,具體如下:
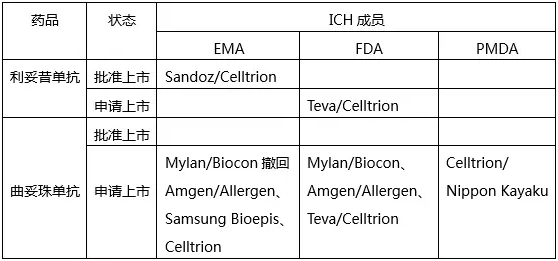
我們再來看看NRA批準情況。
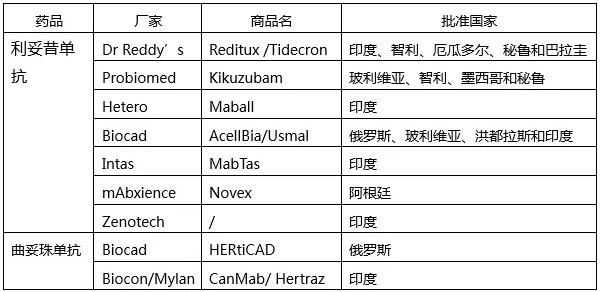
我國尚未批準利妥昔單抗或曲妥珠單抗類似物,但申請者卻有不少。具體見下表
*合作夥伴Celltrion;**合作夥伴mAbxience
由上表可知,兩個生物類似物產品紮堆申報現象已經出現。其實原本三生國健遙遙領先,可惜因故撤回,令人惋惜。後起之秀中,複宏漢霖等幾家已經占得先機(複星her2單抗生物類似物投入超2億元)。在麵對國內如此激烈的競爭,加之2017年7月公布新一輪醫保藥價談判結果中原研羅氏美羅華和赫賽汀分別下降45%或58%(兩個規格)和69%,留給類似物產品的利潤空間大幅壓縮,為了擴大市場範圍,有膽識和實力的公司是不是也在考慮走出去曆練曆練。其實,國家也明確鼓勵企業到更廣闊世界去發展。
2017年7月科技部重大新藥創製科技重大專項實施管理辦公室下發《關於組織重大新藥創製科技重大專項2018年度課題申報的通知》,其中公開擇優課題中關於國產藥品國際化相關研究明確指出“支持國產化學藥、中藥和生物藥及其製劑開展國際臨床研究,進行臨床研究數據的評價,研究製定相關技術標準,突破相關關鍵技術及技術壁壘,在歐美等發達國家或“一帶一路”沿線國家注冊上市,或通過WHO預認證。”
如此說來,國內企業可以主動出擊促進CFDA與WHO開展合作,響應科技部號召,向WHO提交生物類似物在內的藥品預認證申請。尤其是同為複星醫藥旗下複宏漢霖繼是不是也會考慮進軍WHO市場呢?這樣不僅可以開拓藍海市場,也可以在另一個國際舞台上展現中國製藥人的麵貌,實現國家和企業共同前進。
















 相關新聞
相關新聞