罕見病是指盛行率低、少見的疾病。世界各國對於罕見疾病的定義不盡相同,世界衛生組織將罕見病定義為患病人數占總人口的0.65‰~1‰的疾病或病變。中華醫學會醫學遺傳學分會提出的中國罕見病定義,為患病率低於1/500000或新生兒發病率低於1/10000的疾病。
由於患病人群少、市場需求少、研發成本高,很少有製藥企業關注罕見病治療藥物的研發,因此這些藥被形象地稱為“孤兒藥”。
由於美國FDA等的注冊法規扶持,國外藥企積極研發孤兒藥。從國內目前已上市的罕見病藥品來看,上市的藥品原研廠家主要是進口藥企。國內企業甚少將新藥研發布局在腫瘤以外的罕見病。 2017年5月11日,CFDA關於征求《關於鼓勵藥品醫療器械創新加快新藥醫療器械上市審評審批的相關政策》(征求意見稿)意見的公告(2017年第52號)再一次重申CFDA支持罕見病治療藥物研發的態度。這是否意味著罕見病用藥將要破冰?
三大利好
罕見病用藥破冰跡象
52號文中利好罕見病及孤兒藥的主要有三個方麵政策:
01、罕見病目錄
罕見病目錄即將發布,由衛生計生部門公布並建立罕見病患者注冊登記製度。這意味著相關罕見病的流行病學數據有望建立;並且相關罕見病的藥物臨床研發找不到患者的問題,有望隨著罕見病患者注冊登記製度的建立而得以解決。
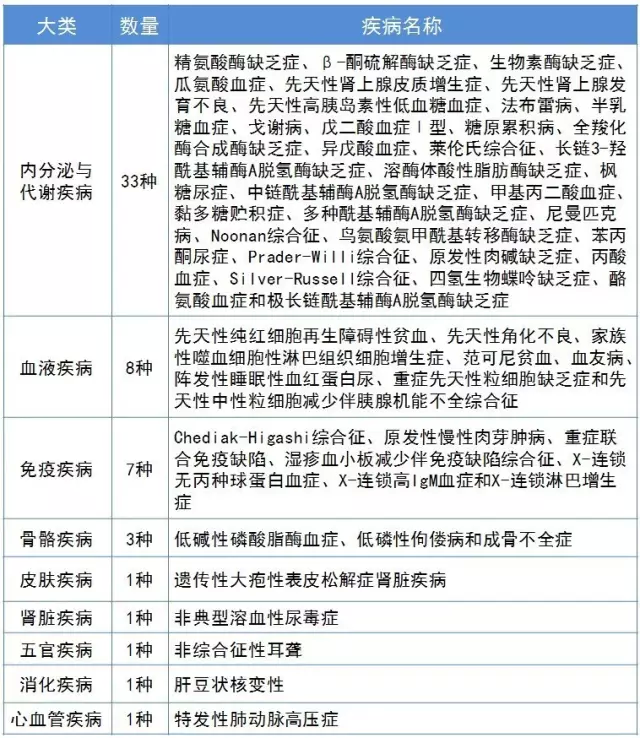
2016年上海公布了《上海市主要罕見病名錄(2016年版)》56種疾病。其中內分泌與代謝疾病最多,共33種;血液疾病8種;免疫疾病7種,骨骼疾病3種,皮膚疾病、腎髒疾病、五官疾病、消化疾病和心血管疾病各1種(見表1)。
表1上海市主要罕見病名錄(2016年版)
02、優先審評
罕見病治療藥物申請人可提出減免臨床試驗申請,加快罕見病用藥審評審批。實際上,2016年《總局關於解決藥品注冊申請積壓實行優先審評審批的意見》(食藥監藥化管〔2016〕19號)中也提到了防治罕見病且具有明顯臨床優勢的藥品注冊申請將獲得優先審評審批。
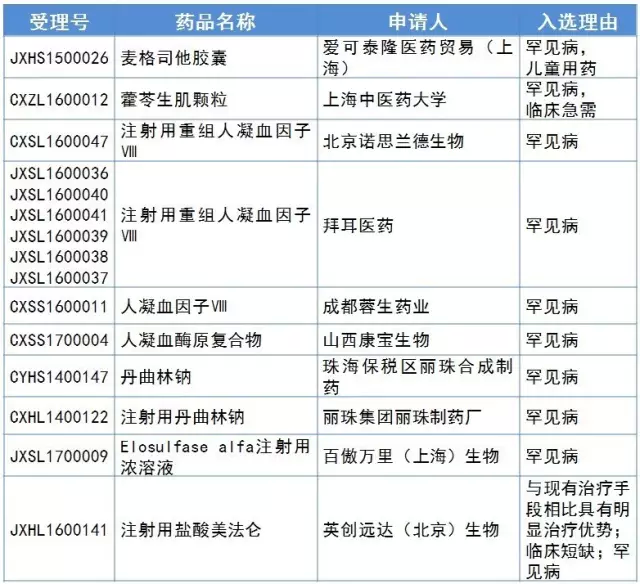
2016年至今,共15個受理號進入擬優先審評審批目錄且都納入了優先審評品種名單。重組人凝血因子Ⅷ是最多生產廠家申報且受理號數最多的產品。從表2可見,我國自主研發的罕見病化學藥新藥獲得優先審評審批的基本沒有。
表2優先審評審批孤兒藥名單
(數據來源:鹹達數據V3.2)
03、豁免臨床審評
對於國外已批準上市的罕見病治療藥物,可有條件批準上市,上市後在規定時間內補做相關研究。
罕見病藥免臨床實際上早有案例,蘋果酸舒尼替尼膠囊2010年獲批的適應症為通過抑製多個靶點而產生抗腫瘤作用和抗血管生成作用。2012年獲批發病率約為0.3/10萬的罕見病乙酰神經內分泌腫瘤時,就是采取全麵考察全球臨床研究數據的基礎上,采取豁免臨床試驗的審評策略批準上市的。
2012年被豁免臨床試驗批準上市的產品除了罕見病藥還有兒童藥,即國際上唯一被批準的治療早產兒呼吸暫停的藥物枸櫞酸咖啡因注射液。2016年成都苑東藥業有限公司作為國內首家仿製申請枸櫞酸咖啡因注射液也獲得優先審評審批,並在2016年獲批。
綜上所述,罕見病藥和兒童藥有條件免臨床早有案例,若此舉措變成政策將推進國內企業積極引進罕見病仿製藥進入國內。
獲批情況回顧
並非每年都有孤兒藥獲批
2010年度CDE發布的藥品審評報告中,提到了原發性肺動脈高壓屬於罕見病。
2010年,批準西他生坦鈉進口上市;批準可溶性鳥苷酸環化酶(sGC)激動劑和長效非前列素類前列環素受體(IP受體)激動劑進入臨床試驗;有條件批準甲磺酸伊馬替尼片用於隆突性皮膚纖維肉瘤(DFSP)的治療;批準用於治療特發性肺纖維化的新化合物的國際多中心臨床試驗。
2012年度藥品審評報告中,提到兩個罕見病用藥獲批,一是治療骨髓增生異常綜合症(MDS)藥物的注射用地西他濱,二是增加乙酰神經內分泌腫瘤這一罕見病適應症的蘋果酸舒尼替尼膠囊。
2013年度藥品審評報告中,提到的曲前列尼爾注射液,為罕見病肺動脈高壓治療藥物。
2015年藥品審評報告中,提到注射用阿糖苷酶α,全球唯一批準用於龐貝病的孤兒藥。
從CDE所公布的藥品審評報告可見,並不是每一年都有罕見病用藥獲批,特發性肺動脈高壓症是獲批最多的適應症。鑒於惡性腫瘤也屬於優先審評審批的適應症範圍,相關適應症不會再走罕見病綠色通道。
進入醫保情況
進醫保難,廠家降價動力不足
2017年醫保目錄中有不少孤兒藥,例如限特異性肺纖維化的其他免疫抑製劑吡非尼酮。2016年進入浙江大病保險特殊藥品支付範圍和醫療救助(專項救助)範圍治療肌萎縮側索硬化症的恩華科魯唑,還有上文所提及的地西他濱和注射用重組人凝血因子Ⅷ。伊馬替尼進入2017年醫保目錄,但上述的罕見病適應症(隆突性皮膚纖維肉瘤)並不在報銷範圍之內。
治療肺動脈高壓的波生坦片也進入了人社部2017年4月所公布的44個醫保談判藥品目錄中,該產品此前已進入山東、沈陽、深圳等省市的大病保險特藥目錄,然而日前有消息指波生坦片在談判中失利,未能進入醫保。
一般而言,孤兒藥主要通過談判進入各省市的大病保險特藥目錄從而獲得報銷,這意味著生產廠家需要和一個個省市的人社部門進行價格談判才能進入醫保目錄。孤兒藥從不缺臨床需求,從生產廠家而言,孤兒藥進入醫保所降低的價格與患者人數增加的數量相較之下,相對而言產品不降價,生產廠家所獲取的市場規模更大。罕見病進入醫保更多地是顯示人文關懷。
總結<<<
目前的財政激勵主要是普遍性的高新產業激勵及科技成果轉化,並沒有專屬的孤兒藥研發或生產免稅的利好政策,國內企業研發孤兒藥新藥的動力不足。
從藥品可及性而言,現階段孤兒藥激勵政策應從保證藥品供應開始,比如國內企業引進國際已上市且證明臨床療效可期的孤兒藥仿製藥。即使原研藥沒有在國內上市,是否孤兒藥仿製藥也能有條件免臨床?














 相關新聞
相關新聞