2017上半年FDA共批準23個新藥,包括16個新分子實體和7個新生物製品。這個數字已經超過2016年全年批準的新藥數量總和。近20年來批準新藥數量最多的年份是2015年的45個,上半年批準了14個新藥。如果按此趨勢持續下去,2017年批準的新藥數量將創下曆史新高。
2017上半年FDA批準的新藥
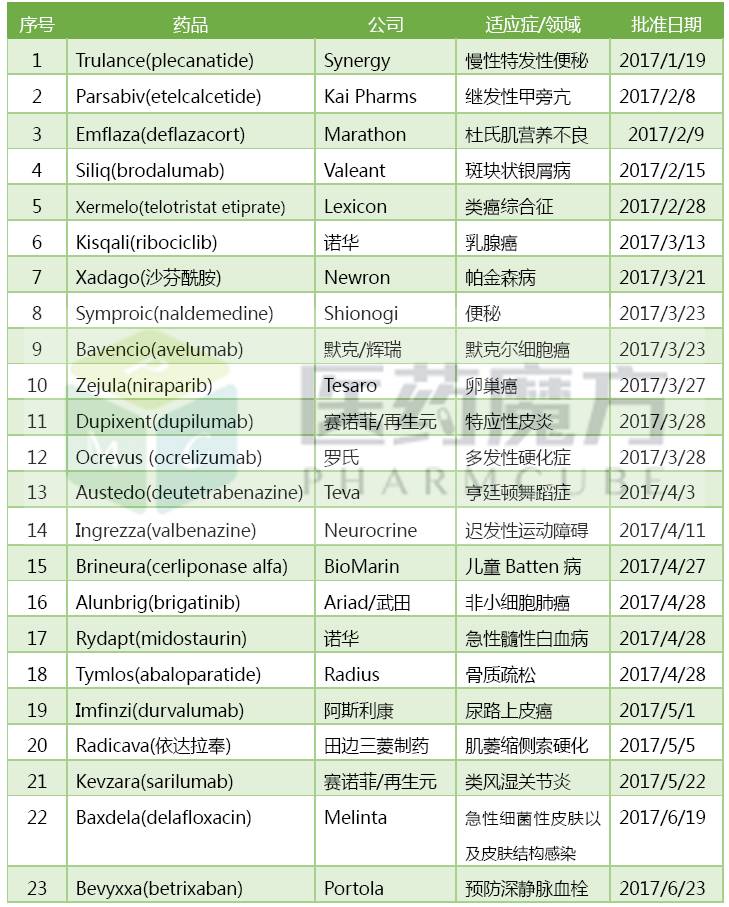
從市場潛力上看,賽諾菲/再生元在2017上半年獲批上市了治療特應性皮炎的dupilumab(IL-4Rα單抗)和治療類風濕關節炎的sarilumab(IL-6R單抗)這兩個單抗藥物,成為最大贏家。EvaluatePharma預測dupilumab在2022年可以實現45億美元的銷售收入。
FDA上半年批準的最讓人意外的新藥是治療肌萎縮側索硬化的Radicava (依達拉奉)。這是一個率先在日本上市的藥物,在沒有美國臨床試驗數據支持的情況下,隻憑借日本患者中的研究數據就獲得FDA批準上市。
其他比較值得關注的新藥包括阿斯利康的PD-L1單抗durvalumab,獲批治療晚期尿路上皮癌,是全球第5個上市的PD-1/PD-L1類藥物,EvaluatePharma對其2022年銷售額預測為20億美元。羅氏ocrelizumab是首個獲批可同時治療複發緩解型多發性硬化症(RRMS)和原發性進展型多發性硬化症(PPMS)的藥物。
下麵對藥物做一簡單介紹
1、Trulance(plecanatide)
Plecanatide是第一個尿鳥苷素類似物,由Synergy Pharmaceuticals開發,屬於鳥苷酸環化酶-C(GC-C)激動劑,能夠刺激腸液分泌,促進腸功能正常化和規律的排便。Trulance的批準劑量方案為口服3mg,每日1次,可在任何時間服用,不受進食影響。
慢性特發性便秘一種複雜的功能性胃腸道紊亂疾病,其症狀包括每周少於3次的腸運動,腸梗阻等,病因及病理生理過程尚不明確。CIC影響約3300萬美國人,占全球人口的14%。
在一項涉及2600例患者的大型III期、雙盲、安慰劑對照研究中,與安慰劑相比,Trulance治療12周,患者大便頻率(每周自發排便次數),大便稠度(由布裏斯托大便量表測量)有顯著改善。Plecanatide最常見的不良反應是腹瀉,禁用於6歲以下兒童。
2、Parsabiv(etelcalcetide)
腎功能減退、礦物質代謝紊亂可導致甲狀旁腺分泌大量的甲狀旁腺激素(PTH),引起繼發性甲狀旁腺功能亢進,這個疾病在透析患者中的發生率約為88%,在血液透析患者中的發生率為79%。
新型擬鈣劑etelcalcetide可與甲狀旁腺鈣敏感受體結合並激活受體,繼而降低PTH水平。因其可在血液透析後靜脈給藥,優於現有的標準擬鈣劑治療藥西那卡塞。etelcalcetide在2月7日獲批治療成年血液透析患者的繼發性甲狀旁腺功能亢進,是12年來首個獲批用於治療透析患者繼發性甲狀旁腺功能亢進的藥物。
在2項隨機、雙盲、III期對照試驗中,1023例中重度繼發性甲狀旁腺功能亢進的血液透析患者(PTH > 400 pg/mL)除接受標準治療(維生素D和/或磷酸鹽結合劑)外,在透析(3次/周)結束時隨機給予靜脈注射etelcalcetide或安慰劑。
結果顯示,治療20~27周後,兩項研究中etelcalcetide組患者PTH水平較基線值降低30%的患者比例分別為77%和79%,而安慰劑組則為11%和11%;etelcalcetide組PTH水平≤300 pg/mL的患者比分別為52%和56%,而安慰劑組患者僅為6%和5%。
3、Emflaza(deflazacort)
杜氏肌營養不良症(DMD)是一種X染色體隱性遺傳疾病,由抗肌營養不良蛋白基因(dystrophin gene)突變所致,主要發生於男孩。全球平均每3500個新生男嬰中就有一人罹患此病。患者在學齡前就會因骨骼肌不斷退化出現肌肉無力或萎縮,導致不便行走。大部分DMD患者在3-5歲發病,7-12歲徹底喪失行走能力,20歲左右會因為心肌、肺肌無力死亡。
去年9月,FDA有條件批準了首個DMD藥物Exondys 51(eteplirsen),適用於抗肌營養不良蛋白基因(dystrophin gene)中存在51號外顯子跳躍(exon 51 skipping)的DMD患者,可以覆蓋大約13%的DMD患者群體。
與Exondys 51不同,Emflaza適用於所有類型基因突變的DMD患者,用於5歲及以上DMD患者的治療,是全球首個獲批治療DMD的皮質類固醇藥物。
4、Siliq(brodalumab)
2月15日,FDA批準了Valeant製藥的Siliq(brodalumab),用於對係統性療法或光照療法(紫外線治療)不響應的成人中重度斑塊狀銀屑病的治療,屬於二線用藥。
Brodalumab是一種IL-17R抑製劑,能選擇結合IL-17受體,阻止IL-17A、IL-17F及其它類型IL-17與受體的結合,是繼諾華Secukinumab和禮來Ixekizumab之後FDA批準的第三個針對IL-17通路的單抗藥物。
Brodalumab最初由安進研發,之後授權給了阿斯利康和日本協和發酵麒麟株式會社。2015年5月,臨床數據顯示brodalumab與患者自殺傾向相關,安進隨之宣布終止與阿斯利康關於brodalumab的合作,放棄了對Brodalumab的開發。
阿斯利康在與安進分手3個月後,2015年9月將brodalumab以總計4.45億美元的價格將brodalumab的全球獨家開發和商業化權利(除了日本及其他一些亞洲國家,這些地區由協和發酵麒麟持有)授權給了Valeant。Siliq雖然成功上市,但帶有警示自殺風險的黑框警告。
5、Xermelo(telotristatetiprate)
類癌瘤比較罕見且增長緩慢,大多發現於胃腸道。類癌瘤綜合征在類癌瘤患者中的發生率不到10%,往往在腫瘤擴散至肝髒後才會發生。這些患者的腫瘤細胞會釋放過多數量的血清素,從而導致腹瀉。
無法控製的腹瀉綜合征將會導致患者體重下降、影響不良、脫水以及電解質紊亂等。在此情況下,生長抑素類似物能夠抑製部分生長激素的分泌,緩解與功能性胃腸胰酶內分泌瘤有關的症狀和體征,但其沒有特異性,僅能對類癌瘤綜合征的腹瀉情況起到緩解作用,且容易引起患者體內的激素分泌水平。
FDA批準的Xermelo片劑與SSA聯合,患者隻需每日口服3次即可抑製血清素產生,減少類癌瘤綜合征腹瀉次數。
6、Kisqali(ribociclib)
FDA批準3月13日批準諾華Kisqali(ribociclib,LEE011)上市,聯合芳香酶抑製劑一線治療HR+/HER2-晚期或轉移性乳腺癌。Kisqali以突破性藥物和優先審評通道獲得FDA批準,NDA的審評時間僅曆時4.5個月。Kisqali是繼輝瑞Ibrance(palbociclib)之後全球第2個上市的CDK4/6抑製劑。
在一項涉及668例絕經後HR+/HER2-晚期或轉移性乳腺癌患者的III期MONALEESA-2研究中,中期分析時,ribociclib聯合來曲唑作為一線療法相比來曲唑單藥治療可以使疾病進展或死亡風險降低44%。Ribociclib+來曲唑中位PFS顯著延長(19.3個月~未到達),來曲唑組為14.7個月(13.0~16.5個月)。繼續隨訪11個月後,兩組PFS分別為25.3和16.0個月。總生存期數據尚未獲得。
7、Xadago(沙芬酰胺)
帕金森病是老年人中繼阿爾茨海默氏病後第二大常見的慢性進行性神經變性疾病,全球大約700 ~1000 萬例患者,其中 100 萬例患者在美國。
帕金森病患者藥物治療後期會出現“開-關現象”。“開”是指藥物對患者可以起到明顯的治療效果,病人能夠運動;“關”是指患者運動能力喪失。“開-關現象”會隨藥物治療時間的延長而愈發嚴重。生活中表現為病人突然變得僵硬不能運動,僵直持續幾分鍾,然後又突然能運動,隨著病程的延長,這種狀態持續時間越來越長,甚至僵直能長達數小時之久。
“開-關現象”與疾病本身的病情波動引起的運動障礙不同,是不可預知的,而且較多見於年齡偏小的帕金森病人。
FDA此次批準的 Xadago(沙芬酰胺)是作為一種輔助藥物用於用於正接受左旋多巴 / 卡比多巴治療並經曆“關”期發作的患者。
8、Symproic(naldemedine)
FDA批準naldemedine用於治療成人非癌性慢性疼痛患者服用阿片類藥物引起的便秘(OIC)。Naldemedine是每日口服一次的外周作用μ阿片受體拮抗劑。
便秘是阿片類藥物的最常見副作用之一。當阿片類藥物與胃腸道中的阿片受體結合時,可能會誘發便秘。在慢性非癌性疼痛患者中,便秘患病率為40%~50%。
9、Bavencio(avelumab)
轉移性默克爾細胞癌是一種罕見的侵襲性皮膚腫瘤,確診後1年生存率低於50%,5年生存率低於20%。FDA在3月23日批準Bavencio(avelumab)20mg/ml注射液上市,用於治療12歲以上青少年及成人轉移性默克爾細胞癌患者。
Bavencio獲得過FDA授予的突破性藥物資格,此次是憑借應答率和應答持續期數據以優先審評的方式獲得FDA加速批準,是全球第4個上市的PD-1/PD-L1類藥物,也是第一個獲批治療轉移性默克爾細胞癌的PD-L1單抗。
Avelumab的療效和安全性在一項代號為JAVELINMerkel200的單臂、開放、多中心研究中得到證實。JAVELIN Merkel 200研究納入88例經組織病理學確認且接受化療後進展的轉移性默克爾細胞癌患者,65%接受過一種療法,35%接受過2種以上療法,給予每2周1次avelumab 10mg/kg治療,直至疾病進展或出現不可耐受毒性。
結果顯示,總應答率為33%,其中11%為完全緩解,22%為部分緩解。產生應答的患者中,有86%可持續6個月以上,45%可持續12個月以上,應答持續期為2.8~23.3個月。最常見的不良反應包括疲勞(50%),骨骼及疼痛(32%),腹瀉(23%),惡心(22%),注射部位反應(22%),疹(22%),食欲減退(20%)和外周性水腫(20%)。
10、Zejula(niraparib)
Niraparib是一種口服PARP抑製劑,主要針對的是BRCA1/2基因突變的癌症,開發用於卵巢癌和乳腺癌,此次獲FDA批準上市,用於接收鉑類藥物治療後完全應答或部分應答但又疾病複發的成人卵巢上皮癌、輸卵管癌和原發性腹膜癌患者的維持治療(延緩腫瘤生長)。據國立癌症研究所估計,美國2017年將有22000例上述新確診癌症患者,14000例死亡患者。
2016年9月29日,再鼎醫藥與Tesaro達成戰略合作協議,獲得Niraparib在中國市場的獨家研發和銷售權,Tesaro保留可能參與Niraparib在中國共同銷售的選擇權。此外,Tesaro從再鼎醫藥獲得兩個新型的處於研發階段的免疫腫瘤新藥項目海外合作的選擇權。
Zejula是FDA繼續阿斯利康Lynparza(奧拉帕尼,2014/12/19)、Clovis Oncology公司Rubraca(rucaparib,2016/12/19)之後,FDA批準的第3個PARP抑製劑。
11、Dupixent(dupilumab)
特應性皮炎是一種常見的複發性、慢性炎性皮膚疾病,患者通常表現為以炎症和瘙癢為特點的慢性皮疹。中重度特應性皮炎患者通常全身絕大部位皮膚長滿紅疹,引發強烈持續的瘙癢、皮膚幹燥、結痂、滲液,治療藥物非常有限。特應性皮炎影響1800萬~2500萬美國人,其中嬰兒和兒童占8%~18%,大約30萬成人亟需治療藥物。
dupilumab獲得過突破性療法資格,以優先審評方式獲批,是FDA批準的首個治療特應性皮炎的生物製品,EvaluatePharma預測2022年銷售額可達45億美元。
Dupixent是一種預填充注射器,患者在接受初始負荷劑量後,可自行給藥,每2周1次,可以與局部用皮質甾體藥物聯用,也可以單獨使用。禁用於對dupilumab過敏的患者。
FDA去年12月14日剛剛批準輝瑞花費52億美元收購Anacor獲得的小分子特應性皮炎藥物Eucrisa(crisaborole,非甾體PDE4抑製劑),是15年來FDA批準的第一個治療特應性皮炎的新分子實體,銷售峰值預測可達20億美元。
12、Ocrevus(ocrelizumab)
多發性硬化症(MS)是一種人體免疫係統異常攻擊大腦、脊髓、視神經的神經細胞髓鞘而引起的慢性疾病,表現為肌肉虛弱、疲勞、視物困難,最終導致殘疾。全球大約有230萬例MS患者,目前尚無法完全治愈,包括複發緩解型多發性硬化症(RRMS,85%)和原發性進展性多發性硬化症(PPMS,15%)兩種類型。
Ocrelizumab是選擇性靶向CD20+B細胞的人源單抗。CD20+B細被認為與髓鞘和軸突損傷有關,臨床前研究結果顯示,ocrelizumab可以選擇性地與B細胞表麵的CD20結合,而不影響幹細胞或血漿細胞,可以發揮神經保護功能。
Ocrelizumab起始劑量為600mg,分2次給藥,每周1次300mg,之後治療劑量為600mg,每6個月1次。Ocrelizumab是目前為止最長效的MS治療藥物,也是首個獲批可以治療兩種類型MS的藥物。
Ocrelizumab由羅氏與Biogen合作開發,根據合作協議,ocrelizumab上市後,Biogen可從羅氏的銷售收入中獲得一定比例分成,其中美國市場的分成比例為13.5%~24%,美國以外市場為3%。
13、Austedo(deutetrabenazine)
deutetrabenazine是已上市亨廷頓藥物四苯喹嗪的氘代產物,與原化合物相比,氘代後藥代動力學特征得到改善,半衰期明顯延長,從而可以降低治療劑量。deutetrabenazine最初由Auspex公司開發,Teva在其III期臨床數據發表後的4個月以32億美元收購Auspex。
deutetrabenazine曾獲得FDA授予的孤兒藥資格,是FDA批準的第2個亨廷頓病藥物,也是FDA批準的第一個氘代產品。
14、Ingrezza(valbenazine)
valbenazine是FDA批準的首個治療遲發性運動障礙的藥物。遲發性運動障礙是一種神經障礙,其特點是重複的不自主運動,通常是下巴、嘴唇和舌頭,如扮鬼臉、伸出舌頭及摑嘴唇。一些受影響的人也經曆不自主的四肢運動或呼吸困難。
遲發性運動障礙是一種神經疾病,表現為舌、唇、口的異常不自主、緩慢不規則運動,以口周運動障礙最常見,包括轉舌及伸舌運動、頜部咀嚼運動及撅嘴等。某些患者的軀幹或四肢也會受到影響,或遭遇呼吸困難。
遲發性運動障礙通常是由吩噻嗪類及丁酰苯類藥物所引起。口服普通抗精神病藥發生率為20%~40%,使用長效抗精神病藥發生率約50%。
Valbenazine的常見不良反應包括嗜睡、QT間期延長,禁用於先天性長QT間期綜合征患者。服用Valbenazine的患者應避免駕駛或操作重型機械。
15、Brineura(cerliponase alfa)
Brineura是FDA批準的首個治療晚發嬰兒型神經元蠟樣脂褐質沉積症(CLN2,又稱兒童Batten病)的藥物,以延緩3歲及以上症狀性兒科患者行走能力的喪失。
Brineura是一種酶替代療法,其活性成分(cerliponase alfa)是人類TPP1的重組形式,而CLN2病患者恰恰缺乏這一重要的酶蛋白。
Brineura在3歲以上兒科患者中的推薦劑量是300mg,每隔1周通過腦室內輸注一次,然後輸注電解質。完整的Brineura輸液,包括所需的腦室內電解質輸注持續約4.5小時。建議在開始輸液前30至60分鍾,預先施用抗組胺藥物或皮質類固醇。
16、Alunbrig(brigatinib)
brigatinib被FDA加速批準用於治療克唑替尼耐藥後的ALK突變陽性NSCLC。在一項222例克唑替尼耐藥患者中,brigatinib90和180mg治療組的總體應答率分別為48%vs53%,其中完全緩解率分別為3.6%和4.5%。在基線有可測量腦轉移病灶的患者中,90和180mg組顱內ORR分別為42%和67%。
brigatinib是FDA繼輝瑞克唑替尼、諾華色瑞替尼、羅氏alectinib之後批準的第4個ALK+肺癌靶向藥物。
17、Rydapt(midostaurin)
AML是一種快速進展的血液和骨髓腫瘤,發病率隨年齡的增大而明顯升高,中位發病年齡為66歲。在美國的AML中,適合接受骨髓移植的患者不足10%,而且大多數患者對化療無響應並且會進展成複發或難治性AML,5年生存率大約20%~25%。根據美國癌症研究所的估計,2016年美國大約有19930例新確診AML患者,10430例死亡AML患者。
FLT3突變是AML患者中一種常見的基因突變,與患者預後較差相關。midostaurin是一種口服多激酶抑製劑,可抑製多種調控細胞生長的關鍵激酶,包括Flt3,因此被開發用於攜帶FTL3突變的急性髓性白血病(AML)患者的治療。midostaurin是首個用於治療AML的靶向藥物。FDA還批準Rydapt用於治療罕見血液疾病(侵襲性全身性肥大細胞增多症)。
FDA曾授予midostaurin優先審評、快速通道(肥大細胞增多症)和突破性藥物資格(AML)。一項代號為RATIFY的隨機研究入組了717例初治AML患者,結果顯示,與僅接受化療的患者相比,Rydapt聯合化療可顯著延長患者的生存期(74.7 vs 25.6個月)。
18、Tymlos(abaloparatide)
Abaloparatide是一種甲狀旁腺激素相關蛋白(PTHrP)類似物,能與甲狀旁腺受體1結合,從而起到調節代謝,促進骨骼形成的作用。在ACTIVE臨床試驗(18個月的數據)與ACTIVExtend臨床試驗(前6個月的數據)中,與安慰劑相比,abaloparatide能使新發椎體骨折風險降低86%,非椎體骨折風險降低43%。此外,新發椎體骨折與非椎體骨折的絕對風險也分別降低了3.6%和2.0%。
abaloparatide注射液上市被FDA批準用於治療患有骨質疏鬆症風險的絕經後女性,是近15年來FDA批準的首個成骨類合成代謝藥物。
19、Imfinzi(durvalumab)
durvalumab是全球第5個上市的PD-1/PD-L1類藥物,是繼羅氏、默克/輝瑞後第3個上市的PD-L1單抗。
在一項納入了182例既往接受過鉑類化療後疾病進展的晚期或轉移性尿路上皮癌患者的單臂臨床試驗中,給予每2周注射1次10mg durvalumab治療,其總體客觀緩解率到達了17%,在95名PD-L1陽性表達的患者中,總體緩解率為26.3%。正是基於這一積極的臨床試驗數據,FDA終極加速批準了這一藥物,相較預期提前了6個月左右。
20、Radicava(依達拉奉)
依達拉奉是FDA自1995年以來批準的首個肌萎縮側索硬化(ALS)新藥。需要注意點是,依達拉奉於2015年首次被日本和韓國批準治療ALS,FDA此次批準依達拉奉治療ALS主要是基於在日本患者中進行的為期6個月的臨床研究的結果。
ALS是一種罕見的未知病因的神經退行性疾病,該病患者身體中動用肌肉所必需的運動神經元被損壞,導致了像舌頭、脖子和四肢之類裏的所有肌肉的癱瘓。在美國,大約有12000-15000名ALS患者。這種疾病具有漸進的特性,患者的症狀會不斷惡化,大部分患者會在症狀產生後的3到5年內會由於呼吸衰竭而死亡。
21、Kevzara(sarilumab)
sarilumab屬於IL-6R單抗,原本在2016年底就應該上市,但由於現場檢查發現了一些缺陷,一直延後到今年5月才被FDA批準上市。不過作為FDA在羅氏托珠單抗、強生司妥昔單抗之後批準的第3款IL-6/IL-6R靶向藥物,大家對sarilumab也有很高的市場預期。
托珠單抗有靜脈注射或皮下注射兩種用藥方式,每周用藥1次,而 Sarilumab可以 每2周用藥一次。sarilumab治療類風濕關節炎的價格為每年 3.9 萬美元,比起臨床應用最廣泛的兩種 TNF 阻滯劑修美樂(阿達木單抗)和安進的依那西普 低大約1/3。
22、Baxdela(delafloxacin)
Delafloxacin是一種氟喹諾酮類抗生素,與其他喹酮類抗菌劑相比,對革蘭氏陽性菌更有效,特別是對其他喹諾酮類抗菌劑耐藥的甲氧西林耐藥金黃色葡萄球菌(MRSA),此次FDA批準的劑型為300mg注射劑。
Delafloxacin的療效得到了兩個III期臨床研究的支持。研究證明了靜脈注射或口服delafloxacin的單藥療法在48~72小時早期臨床反應的主要終點上不劣於萬古黴素(vancomycin)和阿茲特龍(aztreonam)的結合療法。
急性細菌性皮膚和皮膚結構感染是一個具有挑戰性的醫學難題。由於細菌對現有抗菌藥物的耐藥性提高,由耐甲氧西林金黃色葡萄球菌(MRSA)導致的發病率、並發症和住院率顯著上升。
23、Bevyxxa(betrixaban)
betrixaban是每日一次的口服Xa因子抑製劑,是利伐沙班、阿呱沙班、依度沙班之後全球上市的第4個直接Xa因子抑製劑類抗凝血藥。
FDA此次批準是基於隨機、雙盲、多中心、 APEX研究(NCT01583218)的數據,試驗將 Betrixaban 延長治療(35-42 天)與依諾肝素短期治療(6-14 天)對急性住院患者 VTE 的預防效果進行了對比。有意思的是,盡管該研究未能到達主要終點(p=0.054),FDA仍給予了betrixaban上市許可。















 相關新聞
相關新聞