隨著政策與資本的支持、技術的積累與海外人才的回歸,將創新成果推向國際市場已成為企業快速成長的路徑之一,一方麵,創新藥80%以上的市場在海外,通過國際市場可以實現創新產品的高預期增長;另一方麵,走海外路徑有助於在國內獲得更快的報批資格。
創新藥國際化,除常見的海外並購、授權許可、合作開發外,申請創新藥的海外臨床研究尤其是美國的臨床研究也越來越常見。本文列舉了2016年以來被FDA批準臨床的13個中國創新藥,共來自9家企業,既有恒瑞這樣的“老牌”企業,也有百濟神州、亞盛醫藥這樣的創新性開發企業。
恒瑞醫藥SHR係列
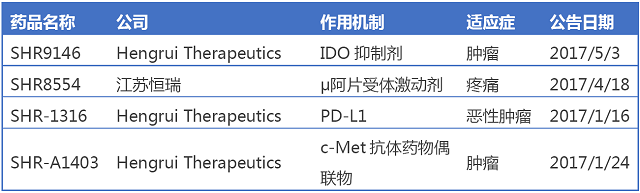
Hengrui Therapeutics是恒瑞在美國的子公司,從事項目引進及藥物發現活動。該公司的在研藥物最初包括從江蘇恒瑞分離出來的三個腫瘤候選藥物吡咯替尼、SHR-A1201 (anti-HER2 ADC)、SHR1210(anti-PD1)。2016年6月,該公司獲得恒瑞醫藥與一家未披露的藍籌投資機構的1億美元投資。2017年以來,恒瑞醫藥4個在美國獲批臨床的創新藥中,有三個由Hengrui Therapeutics申報。
SHR9146為口服小分子IDO抑製劑,IDO抑製劑是目前對抗PD-1耐受最成熟的靶點,BMSOpdivo/默沙東Keytruda這兩個目前最火的PD-1抗體競相與INCYTE的IDO抑製劑展開合作。恒瑞自身也擁有PD-1單抗SHR-1210,目前用於非小細胞肺癌已經啟動III期臨床,公司可以說是目前為數不多的同時自身擁有PD-1抗體和IDO管線的企業。SHR8554注射液是一種μ阿片受體(MOR)激動劑,適用於疼痛的治療。目前μ阿片受體(MOR)激動劑已有可待因、呱替啶·、氫可酮等多個藥物上市。
SHR-1316以PD-L1為靶點,主要用於惡性腫瘤的治療。國際同類產品已有羅氏ATEZOLIZUMAB、阿斯利康durvalumab和輝瑞avelumab。國內同類產品思路迪/康寧傑瑞的PD-L1抗體(KN035,重組人源化PD-L1單域抗體 Fc 融合蛋白)已經通過CFDA和 FDA 的審評,獲準開展臨床研究,基石藥業重組PD-L1全人單克隆抗體注射液 (WBP3155)臨床申請已獲CFDA受理。
SHR-A1403是人源化抗c-Met單克隆抗體通過化學偶聯微管抑製劑之後形成的抗體藥物偶聯物,可與腫瘤細胞表麵的c-Met結合,抗體藥物偶聯物內吞進入腫瘤細胞後釋放小分子毒素,起到殺傷腫瘤細胞的作用,這是中國企業第一個獲美國FDA批準臨床的抗體藥物偶聯物。
東陽光藥伊非尼酮
2月22日,東陽光抗纖維化1類新藥伊非尼酮(HEC585)獲得美國FDA許可正式進入I期臨床。5月4日,公司宣布已在科文斯(美國)I期臨床試驗中心順利啟動並於2017年5月2日成功完成2例受試者的首次給藥。伊非尼酮是由東陽光藥業自主開發的的新化學實體,主要開發用於特發性肺纖維化(IPF)。目前用於肺纖維化藥物的藥物有羅氏吡非尼酮和BI的尼達尼布,其中吡非尼酮是首款用於IPF的藥物,推測伊非尼酮是吡非尼酮的同類藥物。
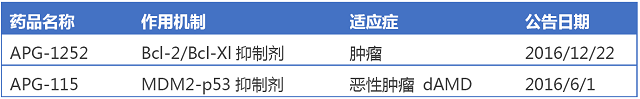
亞盛醫藥APG-1252、APG-115
亞盛醫藥由楊大俊、郭明和王少萌3位博士在2009年創立,專注於創新靶向小分子抗癌藥物的研發和產業化。
2016年12月22日,亞盛醫藥宣布公司作用於新靶點Bcl-2家族蛋白的抗腫瘤藥物APG-1252獲FDA批準開展臨床試驗。擬開發適應症是包括小細胞肺癌(SCLC)等在內的實體腫瘤。APG-1252能夠選擇性抑製Bcl-2蛋白家族成員Bcl-2/Bcl-XL,恢複腫瘤細胞程序性死亡機製,從而殺死腫瘤。目前Bcl-2抑製劑上市藥物有艾伯維Venetoclax (維奈妥拉),2016年4月11日被FDA批準上市,用於慢性淋巴細胞白血病。APG-115為口服靶向MDM2-p53蛋白結合的小分子抑製劑,p53是公認的腫瘤抑製基因,而 MDM2是p53的一個重要的抑製因子,當兩者結合的時候,會使p53的活性降低,抑癌作用減弱。國際上目前沒有同類藥物上市。臨床前研究表明,APG-115對於惡性腫瘤、幹性老年眼底黃斑病變有治療作用。此外公司臨床開發進度最快的產品Bcl-2抑製劑AT-101,現處於國內及美國Ⅱ期臨床試驗階段,另外,公司IAP(凋亡抑製蛋白)抑製劑AT-406在美國已處於I期臨床。
康寧傑瑞KN035
2016年11月29日,蘇州康寧傑瑞生物科技有限公司宣布,公司自主知識產權一類新藥——KN035重組人源化PD-L1單域抗體Fc融合蛋白注射液通過FDA審評,獲準在美國開展臨床研究,這是首個在美進入臨床的、中國研發企業自主開發和製造的抗體類創新藥。KN035重組人源化PD-L1單域抗體Fc融合蛋白注射液是國內首個申報臨床的PD-L1靶點的生物製劑,也是全球首個PD-L1靶點的單域抗體。
複宏漢霖HLX07
2016年10月13日,複宏漢霖發布公告稱控股子公司 Henlix收到FDA關於同意HLX07(Anti-EGFRHumanizedMonoclonalAntibody)注射液進行臨床試驗的函。Henlix是複宏漢霖司通過台灣控股子公司漢霖生技股份有限公司設立之全資子公司,設立於美國。HLX07是複宏漢霖主研發的單克隆抗體改良創新生物藥,用於結直腸癌等多種實體癌的治療。全球上市的EGFR單抗主要有西妥昔單抗注射液、尼妥珠單抗注射液、帕尼單抗注射液。2015年西妥昔單抗注射液、尼妥珠單抗注射液、帕尼單抗注射液於全球銷售額分別約為13.6,0.36 ,5.5 億美元。
聖諾製藥STP705
2016年11月7日,聖諾製藥公司宣布其首選藥物STP705(Cotsiranib)IIa期臨床研究獲得FDA批準。試驗主要用於評估公司在研藥物STP705在患有增生性瘢痕的受試者中各種劑量的安全性和有效性。STP705由兩種siRNA寡核苷酸組成,分別以TGF-β1和COX-2的信使核糖核酸(mRNA)為靶向,已知TGF-β1是異常纖維化反應的關鍵調節因子,而COX-2則是促發炎症和增殖介質的調節因子。STP705可降低TGF-β1和COX-2水平,促進成纖維細胞的凋亡、減少瘢痕產生。聖諾製藥成立於2007年,創始人兼首席執行官為陸陽博士,公司總部設在美國馬裏蘭州,並於2008年在中國蘇州建立了中國研發中心,公司致力於核酸幹擾(RNAi)藥物的開發。
康弘藥業康柏西普
2016年10月10日,康弘藥業發布公告稱公司FDA準許康柏西普眼用注射液在美國開展濕性年齡相關性黃斑變性(wAMD)III期臨床試驗.是我國首例一類生物新藥直接進入美國III期臨床。康柏西普由俞德超博士研發,2013/12/4獲CFDA批準上市,用於治療濕性年齡相關性黃斑變性。
艾森醫藥AC0058
2016年2月,艾森1.1類創新藥AC0058獲批在美國開展I期臨床。AC0058通過特異性抑製B淋巴細胞和其它炎症細胞的關鍵調節分子布魯頓酪氨酸激酶(BTK),可用於治療係統性紅斑狼瘡和類風濕性關節炎等自身免疫性疾病。強生/艾伯維重磅血癌藥物Imbruvica目前唯一上市的BTK抑製劑類藥物,2016年Imbruvica全球銷售額30.8億美元,是全球最暢銷的白血病藥物。
除AC0058之外,早在2014年9月,艾森的第三代EGFR靶向抑製劑艾維替尼就獲得美國FDA臨床研究批準。
百濟神州BGB係列
百濟神州是一家來自中國的生物技術公司,不過在2016年2月3日在納斯達克上市。公司主要商業模式是將有前景的在研產品轉讓,以此獲得權利許可費用以及未來的開發和商業裏程金。
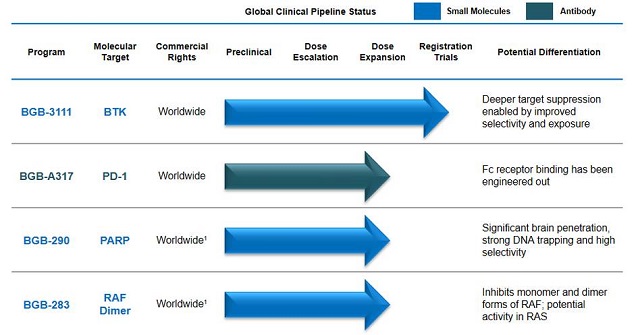
百濟神州目前主要有4個推進至臨床開發階段的候選藥物,均在全球範圍內開展臨床試驗(如下圖所示)。其BTK抑製劑BGB-3111是臨床進展最快的產品,2015年6月獲得FDA批準進行臨床,目前用於華氏巨球蛋白血症已處於III期臨床。PD-1單抗BGB-A317於2016年1月通過FDA新藥研究申請(IND)審評。公司PARP抑製劑BGF-290、B-RAF抑製劑BGF-283則選擇了與默克雪蘭諾合作開發。
百濟神州全球臨床管線
本文為不完全統計,歡迎補充!















 相關新聞
相關新聞