近日,仿製藥質量與療效一致性評價辦公室在CDE網站開通仿製藥質量和療效一致性評價專欄發布《289目錄品種參比製劑基本情況表》,裏麵涵蓋了289目錄品種參比製劑情況,其中169個品種已有參比製劑,“不推薦參比製劑”的有26個品種,“無企業備案暫不推薦”的品種有14個,“研究中”品種有32個,其餘都是沒有推薦參比製劑的其它產品。
“不推薦參比製劑”兩重天:
三類產品淘汰,兩類產品免臨床
“不推薦參比製劑”分為五類,分別是“存在安全性問題,國外已撤市”“國內特有品種,無有效批準文號且無企業備案”“國外OTC專論活性成分,藥學研究應符合相應指導原則要求”“無有效批準文號且無企業備案”“藥學研究應符合相應指導原則要求”。
“存在安全性問題,國外已撤市”的產品有2個,分別為酚酞片和司莫司汀膠囊。
“國內特有品種,無有效批準文號且無企業備案”產品也有2個品規,分別為氫溴酸山莨菪堿片 10mg和鞣酸小檗堿片 50mg。
“無有效批準文號且無企業備案”的產品有17個品規,分別為醋酸甲羥孕酮膠囊0.25g,多巴絲肼片0.125g(0.1g:0.025g)(左旋多巴:苄絲肼),氯雷他定片5mg,雙氯芬酸鈉緩釋膠囊(Ⅰ)50mg及(Ⅲ)50mg、緩釋片 50mg、緩釋片(Ⅰ) 50mg、緩釋片(Ⅴ)100mg,替加氟膠囊50mg及片200mg,硝苯地平緩釋片(含Ⅱ)30mg,鹽酸二甲雙胍膠囊0.5g,鹽酸氯雷他定膠囊及片5mg,鹽酸左氧氟沙星膠囊0.5g,左氧氟沙星片0.2g。
以上三類產品品規預計將自然淘汰。此外,“無企業備案暫不推薦”的產品預計也會被自然淘汰。
此外,“國外OTC專論活性成分,藥學研究應符合相應指導原則要求”的產品有3個,分別為葡萄糖酸鈣片、碳酸氫鈉片和維生素B2片。OTC專論活性成分是指適應症銷售較長時間被證明安全有效的藥品後就被列入OTC專論係統,對於列入OTC專論係統的藥品,其上市無須經過FDA批準,但要求遵守GMP和藥品登記。
“藥學研究應符合相應指導原則要求”的產品有2個,分別為口服補液鹽散(Ⅰ)和口服補液鹽散(Ⅱ),這兩個產品都是CDE此前發布的《289基藥目錄中可豁免或簡化人體生物等效性試驗(BE)品種名單(征求意見稿)》中的產品。
“三改產品”別再僥幸了!
必須按“三改”指南進行一致性評價
沒有推薦參比製劑的其它產品中,部分產品的備注為“企業可按‘三改’技術指南進行研究和評估,選擇參比製劑”。所謂“三改”技術指南,指的是2017年第27號公告《總局關於發布仿製藥質量和療效一致性評價工作中改規格藥品(口服固體製劑)評價一般考慮等3個技術指南的通告》,裏麵包括《仿製藥質量和療效一致性評價工作中改規格藥品(口服固體製劑)評價一般考慮》《仿製藥質量和療效一致性評價工作中改劑型藥品(口服固體製劑)評價一般考慮》《仿製藥質量和療效一致性評價工作中改鹽基藥品評價一般考慮》3個技術指南。
筆者認為三個技術指南有兩方麵共性難點:一是立項的科學性、合理性和必要性。二是生物等效性試驗或臨床試驗能否符合指南要求:“改鹽基藥品”要證明優效;“改劑型藥品”以生物等效為立題依據且不顯著改變藥代動力學行為的要與原研劑型參比製劑進行生物等效性試驗,“改劑型藥品”以改變藥代動力學行為的要與原研劑型參比製劑進行相對生物利用度研究及臨床試驗;“改規格藥品”和參比製劑適應症和用法用量相同的,將以改規格藥品和參比製劑以相同劑量給藥(單次給藥劑量不超過最大給藥劑量)進行生物等效性試驗。
從表1所示,仿製藥質量與療效一致性評價辦公室基本已經將“三改”產品整理清晰,對應產品必須按“三改”指南進行一致性評價。
其中,沒有在289目錄中的“改劑型產品”,但同化學成分其它劑型在289目錄且具參比製劑的產品需要警醒,如果289目錄具參比製劑的產品獲批,將會獲得價格優待,屆時再啟動“三改”指南所提的項目將會非常被動。
表1 “三改產品”清單匯總
(數據來源:識敏信息)
備案信息包括地產化信息
地產化信息公布,不再需要進口參比製劑
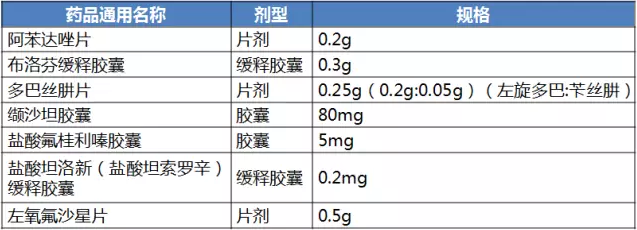
“研究中”產品主要包括“國內特有品種,需進一步研究”“麻醉藥品,特殊管控”“原研地產審核中,暫未公布”三類。其中“原研地產審核中,暫未公布”公布了地產化的7個品規,其中纈沙坦膠囊此前公布的在歐盟上市的原研參比製劑已撤銷。
通過一致性評價的原研藥地產化信息公布後,國內企業將不需要進口國外的參比製劑。
表2 原研地產化產品信息
(數據來源:識敏信息)
小結>>>
《289目錄品種參比製劑基本情況表》信息的公布,公開了哪些產品已麵臨自然淘汰,哪些“三改產品”需要按指南開展項目。289目錄僅剩下一年的窗口期,積極競爭一致性評價的企業已逐步開始準備現場考察等待一致性評價獲批。還在等待參比製劑幹活的企業實質已是半放棄狀態。
值得注意的是,一些銷售規模比較大的289目錄產品,有不少進口仿製藥正在等待上市。如蘭伯西實驗室有限公司和印度瑞迪博士實驗室有限公司都申報了的硫酸氫氯吡格雷片,上海龍德醫療技術有限公司進口申報阿卡波糖片等。















 相關新聞
相關新聞