癌症免疫療法即是通過調動患者的自身抵抗力(免疫細胞)來抵禦、殺死腫瘤細胞,是近年來腫瘤治療的一個新的發展方向,也是當前癌症研究領域中的熱點之一。那麽2017年科學家們在癌症免疫療法研究領域中取得了哪些突破性的進展呢?小編對相關研究進行了整理,分享給大家!
【1】癌症免疫療法新突破!PD-1阻斷療法激活的T細胞還需依賴CD28共刺激
doi:10.1126/science.aaf0683
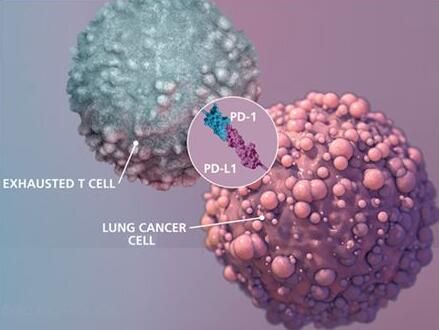
阻斷PD-1通路的抗癌藥物(也被稱作免疫檢查點抑製劑)如今被美國食品藥品管理局(FDA)批準用來治療黑色素瘤、肺癌和幾種其他的癌症。這些藥物經常被描述為在功障礙的T細胞表麵上“鬆開製動器”。
在一項新的研究中,來自美國埃默裏大學醫學院埃默裏疫苗中心和溫希普癌症研究所(Winship Cancer Institute)的研究人員證實,即便鬆開強加在PD-1上的製動器,這些腫瘤特異性的T細胞仍然需要“燃料”進行增殖和恢複有效的免疫反應。這種燃料來自基於CD28分子的共刺激(co-stimulation)。相關研究結果於2017年3月9日在線發表在Science期刊上,論文標題為“Rescue of exhausted CD8 T cells by PD-1–targeted therapies is CD28-dependent”。
盡管PD-1靶向藥物取得成功,但是很多病人的腫瘤並不對它們作出反應。這項研究的發現表明存在於T細胞表麵上的CD28可能是一種能夠預測PD-1靶向藥物是否有效的臨床生物標誌物。此外,對CD28的需求提示著共刺激可能在一些病人體內丟失了,這可能有助指導設計組合療法。
【2】癌症免疫治療重大突破!複蘇的 T 細胞仍需要燃料
DOI:10.1038/nature19330
來自 Emory 疫苗中心和 Winship 癌症研究所的一項新研究表明,即使 PD- 1 施加的製動器被釋放,腫瘤特異性 T 細胞仍需要“燃料”去增殖並恢複有效的免疫應答。這種燃料來自 CD28 分子的共刺激。該研究結果於 3 月 9 日發表在《科學》雜誌上。
PD-1屬於一個成員廣泛的蛋白家族,這個家族的成員還包括 B7, CD28, CTLA- 4 等成員。PD- 1 限製了慢性炎症、感染、癌症中的 T 細胞活性,從而限製自身免疫。阻斷 PD- 1 途徑的抗癌藥物(PD- 1 檢查點抑製劑),現在被 FDA批準用於黑色素瘤,肺癌和其他幾種類型的癌症。這些藥物通常被描述為在功能失調的 T 細胞上“釋放製動”。
盡管 PD- 1 檢查點抑製劑推動了晚期腫瘤的藥物治療的進步。但不同患者在接受治療後的預後仍參差不齊。
【3】癌症免疫療法 “新燃料”——微生物群!
近日,發表在Nature Reviews Cancer雜誌上的一篇綜述文章再次將微生物群與癌症治療聯係起來。作者們回顧了微生物群調節化療、放療以及免疫治療的重要研究進展。他們認為,在癌症和其它疾病中靶向微生物群可能會成為精準醫療和個性化醫療的下一個前沿方向之一。
3月17日,美國NIH的兩位科學家在Nature Reviews Cancer雜誌上在線發表了一篇題為'Microbiota: a key orchestrator of cancer therapy'的綜述文章。作者們回顧了微生物群調節化療、放療以及免疫治療的重要研究進展,討論了參與癌症治療調節的微生物種類、作用機製,以及通過靶向微生物群提高抗癌功效的可能性。
微生物群由共生細菌和生活在宿主上皮屏障上的其它微生物組成,影響著大量的生理功能,包括維持屏障的內穩態,調節新陳代謝、造血作用、炎症、免疫力等。微生物群也參與了癌症的發生、進展和轉移。近期,不斷積累的研究表明,微生物群,尤其是腸道微生物群能夠調節機體對癌症療法的響應以及對毒副作用的敏感性。
【4】揭示癌症免疫療法抵抗癌症新機製
doi:10.1038/nature22396
已經證實抗蛋白PD-1和PD-L1抗體通過激活體內的T細胞(一種免疫細胞)來抵抗癌症。如今,在一項新的研究中,來自美國斯坦福大學醫學院的研究人員證實這種療法也以一種完全不同的方式抵抗癌症:促進巨噬細胞(另一種免疫細胞)吞噬和摧毀癌細胞。這些發現可能在改進和擴大這種癌症療法中發揮著重要的意義。這項研究是以小鼠為研究對象的。相關研究結果於2017年5月17日在線發表在Nature期刊上,論文標題為“PD-1 expression by tumour-associated macrophages inhibits phagocytosis and tumour immunity”。論文通信作者為斯坦福大學醫學院病理學係教授Irving Weissman博士。論文第一作者為Weissman實驗室研究生Sydney Gordon。
PD-1是細胞表麵上的一種蛋白受體,在保護身體免受過度活躍的免疫係統的破壞中發揮著重要的作用。T細胞學著檢測和破壞受損的或病變的細胞,有時能夠錯誤地攻擊健康細胞,從而產生狼瘡或多發性硬化症等自身免疫疾病。PD-1被稱作“免疫檢查點”,能夠抑製高度活躍的T細胞,因此它們更不可能攻擊健康組織。
【5】預測癌症免疫療法療效?這個簡單數值是關鍵
盡管基於阻斷 PD- 1 受體蛋白的癌症免疫療法在轉移性黑色素瘤患者中的已經取得了顯著成功,但仍有一半以上的患者無法獲得持續的療效。出現該現象的一種可能原因,是這些抗 PD- 1 抗體藥物在許多患者體內未能起到生物學效應。然而,一項最新研究表明,這些治療無效的患者中,有 80% 實際上在接受治療後產生了 T 細胞響應。
Pembrolizumab(商品名 Keytruda)就是這樣的一種已上市抗 PD- 1 檢查點抑製劑抗體藥物,其可將 PD- 1 受體這一限製 T 細胞活性的“閥門”打開,以允許 T 細胞增殖並更強烈地對癌細胞做出免疫反應。
活化 T 細胞數量的增多為什麽沒有在這個患者群體中帶來相應的腫瘤縮小呢?最近,賓夕法尼亞大學(University of Pennsylvania)研究人員在《自然》雜誌上發表的一項研究提供了新的線索,可以幫助醫生實時確定哪些患者會對治療無效,並決定可以如何施以額外的療法來提高抗腫瘤效果。
【6】、癌症免疫療法靶向實體瘤新突破
DOI:10.1038/nature22311
基於T細胞的免疫療法對於癌症的治療提供了巨大的希望:在針對血液癌症的初期試驗中已經取得了初步成功。然而,對於實體瘤的治療來說目前仍然十分困難。最近發表在《Nature》雜誌上的一項研究指出,IFN-gamma-T細胞分泌的一類信號分子能夠切斷腫瘤組織的血液供應,因而對於實體瘤治療效果具有重要的影響。
免疫係統是機體抵抗疾病的有力武器,因此科學家們一直在尋找方法利用免疫係統攻擊癌症。如今,研究者們找到了合適的方法。舉例來說,通過將T細胞從患者體內分離出來,進行一係列的'訓練',再導入患者體內,能夠有效地殺傷腫瘤細胞。這一技術在初期臨床試驗中已經取得了成功,但僅僅局限於無法形成腫瘤塊的癌症類型,例如血液癌症。
善於抵抗血液癌症,但對抗實體瘤效果不佳
對於體積較大的實體瘤來說,T細胞的靶向治療效果則有限。盡管將接受訓練的T細胞導入血液係統中,但它們難以進入緊密的腫瘤組織間隙。此外,腫瘤細胞通過分泌一係列的抑製因子能夠削弱T細胞的效應。
【7】免疫療法為何僅對一些癌症有療效?關鍵在於蛋白SLAMF7
doi:10.1038/nature22076
如果我們的免疫係統能夠治愈癌症,將會是怎麽樣?這個假設太過簡單而不是真實的,但是它成為一種新出現的癌症療法(即免疫療法)的基礎。加拿大蒙特利爾臨床研究所研究員、蒙特利爾大學醫學院教授André Veillette博士針對這個快速發展的領域,在Nature期刊上發表了一篇標題為“SLAMF7 is critical for phagocytosis of haematopoietic tumour cells via Mac-1 integrin”的論文。Veillette博士和他的團隊發現為何免疫療法在一些病人體內有療效,而且其他病人體內是無療效的:SLAMF7分子起著支配作用。
我們的免疫係統含有殺死微生物和其他入侵者的巨噬細胞、T細胞和自然殺傷細胞。但是癌細胞利用多種策略成功地欺騙這些英勇的戰士。免疫療法的作用就是讓這些策略失效,並且提供許多顯著的益處。不同於化療和放療等更加侵入性的療法的是,它靶向癌細胞,並且能夠不傷害健康的細胞。
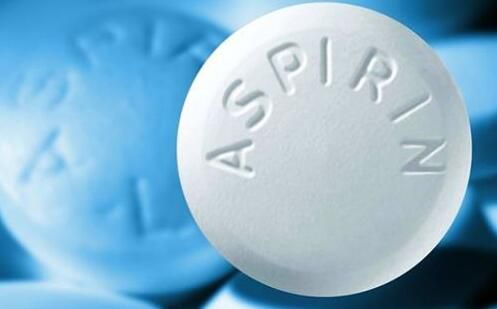
【8】“神藥”新成果!阿司匹林“助攻”癌症免疫療法
5月5日,發表在Science Immunology雜誌上一篇題為“Platelets subvert T cell immunity against cancer via GARP-TGFβ axis”的論文中,來自南卡羅萊納醫科大學(MUSC)的研究人員發現,血小板能夠通過抑製T細胞,幫助癌症“躲過”免疫係統。同時,臨床前研究表明,當聯合了常見的抗血小板藥物(如阿司匹林),T細胞療法能夠更加成功地提高抗癌免疫力。
MUSC的Zihai Li博士是該研究的通訊作者,致力於研究腫瘤究竟是如何躲過免疫係統的。研究小組發現,血小板會釋放一種抑製抗癌T細胞活性的分子——TGF-β。這並不令人意外,因為TGF-β被認為在腫瘤生長中發揮作用已有幾十年。
事實上,大部分TGF-β是不活躍的(inactive)。Li和他的研究小組發現,血小板表麵有一種被稱為GARP的蛋白。該分子具有獨特的能力,能夠捕獲和激活TGF-β。這使得血小板變成了激活型TGF-β的主要來源。換句話說:血小板幫助腫瘤穿上“隱身衣”,躲避免疫係統的攻擊。
【9】一種用於癌症免疫治療的新型T細胞
doi:10.7554/eLife.24476
來自瑞士巴塞爾大學的科學家們首次報告了一種能識別和殺死腫瘤細胞的新型T細胞。這一研究成果公布在eLife雜誌上。
T淋巴細胞(短T細胞)是識別細菌,保護我們的身體免受感染的特殊類型細胞。這種細胞的第二大功能就是驅趕有害細胞,如腫瘤細胞。T細胞能識別腫瘤細胞,因為腫瘤細胞看起來與正常健康細胞不同,通常T細胞是通過T細胞受體(TCR)實現這一功能的,每個受體都能與靶標細胞表明上的一種特殊分子相互作用。TCR識別的一種分子就是MHC I類相關的MR1分子,迄今為止科學家們隻是知道MR1能將TCRs吸引到感染細胞上,但並不清楚MR1還可以將TCR吸引到癌細胞上。
【10】逆轉T細胞精疲力竭改進抵抗癌症和病毒感染的免疫療法
doi:10.1016/j.cell.2017.06.007
在一項新的研究中,來自美國聖猶大兒童研究醫院的研究人員發現T細胞如何變得“精疲力竭(exhausted)”,即不能夠攻擊癌細胞或病毒等入侵者。這一發現是重要的,這是因為接受癌症免疫療法治療的病人經常是沒有反應性的或者經曆疾病複發,而且有人已提出這些挑戰可能歸咎於T細胞精疲力竭。在研究病毒感染或腫瘤的臨床前模型係統中,他們發現一種已在使用的化療藥物能夠逆轉這種精疲力盡。這些發現為開發更加強效的和持久的免疫療法提供一種新的途徑。相關研究結果發表在2017年6月29日的Cell期刊上,論文標題為“De Novo EpigeneticPrograms Inhibit PD-1 Blockade-Mediated T Cell Rejuvenation”。論文通信作者為聖猶大兒童研究醫院免疫學家Ben Youngblood博士。
Youngblood團隊報道這些發現解釋了一種被稱作免疫檢查點阻斷(immune checkpoint blockade)的免疫療法為何經常會失效。在這種治療中,病人接受一種藥物治療,移除對他們的T細胞的抑製,從而允許它們殺死病毒感染細胞或腫瘤細胞。這些抵抗腫瘤的T細胞檢測癌細胞表麵上的一種蛋白抗原,從而觸發這種攻擊。Youngblood說,在這類免疫療法中,T細胞精疲力竭是成功治療的一個重大的障礙。
【11】溶瘤病毒療法有效改善癌症免疫療法的療效,總體反應率高達62%
doi:10.1016/j.cell.2017.08.027
免疫療法有望治療轉移性黑色素瘤(一種侵襲性的致命性的皮膚癌);但是對大多數患者而言,免疫治療藥物迄今為止辜負了人們的期望,提供很少的益處,甚至並不提供益處。在一項針對21名患者的1b期臨床試驗中,來自美國、瑞士、西班牙和澳大利亞的研究人員測試了免疫治療藥物派姆單抗(pembrolizumab)和一種被稱作T-VEC的溶瘤病毒組合使用時的安全性和療效。結果提示著這種組合療法獲得62%的反應率,而且可能要比單獨治療時表現得更好。相關研究結果發表在2017年9月7日的Cell期刊上,論文標題為“Oncolytic Virotherapy Promotes Intratumoral T Cell Infiltration and Improves Anti-PD-1 Immunotherapy”。論文通信作者為美國加州大學洛杉磯分校瓊森癌症中心免疫學項目主任Antoni Ribas。
派姆單抗屬於一類被稱作免疫檢查點抑製劑的藥物。免疫檢查點抑製劑旨在繞過癌症保護自身免受免疫係統攻擊的途徑之一:腫瘤能夠利用免疫檢查點激活體內的天然保護性反應,因而抑製細胞毒性T細胞發起的攻擊。這些藥物的作用機製是取消對免疫檢查點的刹車,從而允許T細胞攻擊腫瘤。
【12】科學家成功鑒別出能限製癌症免疫療法治療效果的特殊“製動機製”
DOI:10.1016/j.immuni.2017.09.012
新型的免疫療法能夠增強機體抵禦癌細胞的免疫防禦力,而對晚期疾病患者進行治療常常會促進患者機體部分腫瘤,甚至全部腫瘤複發,然而諸如這樣的策略在治療晚期癌症患者上常常會以失敗告終,但其背後所涉及的機製研究人員並不清楚;近日,來自馬格德堡大學和波恩大學醫院的研究人員通過研究發現了一種此前並未鑒別出“製動機製”,這種機製能夠限製癌症免疫療法的效率,相關研究結果刊登於國際雜誌Immunity上,該研究或為後期研究人員開發新型癌症免疫療法提供新的思路和機製。
在正常情況下,免疫係統中的T淋巴細胞能夠檢測並且破壞病毒和細菌,而且其還能消滅發生突變的癌細胞,基於免疫檢查點抑製劑的新型療法能夠調整細胞免疫力,從而增強機體免疫係統對癌細胞的識別和殺滅作用,這種新型療法常常被用來治療惡性黑色素瘤患者,而最近這種療法也被用於治療其它實體瘤患者,而且取得了一定的成效。然而,在很多癌症患者中,免疫療法往往並不會或隻會顯示出暫時的治療效應,如今全球的研究人員都在努力研究理解其背後所隱藏的機製。
【13】開發出無需免疫細胞的癌症免疫療法
doi:10.1038/nchembio.2498
對免疫細胞進行基因改造讓它識別和殺死癌細胞是嵌合抗原受體(CAR)-T細胞療法的關鍵,但是這些經過基因修飾的免疫細胞也有潛力給患者帶來問題。作為一種這樣的並發症,細胞因子釋放綜合征是免疫係統過度反應的結果,這種過度反應輕則導致發熱,重則導致器官功能障礙和死亡。在一項新的研究中,來自瑞士蘇黎世聯邦理工學院的研究人員設計出一經接觸就能夠殺死癌細胞的非免疫細胞(nonimmune cell)。相關研究結果於2017年11月13日在線發表在Nature Chemical Biology期刊上,論文標題為“Nonimmune cells equipped with T-cell-receptor-like signaling for cancer cell ablation”。
英國劍橋大學生物學家Simon Davis(未參與這項研究)說,“我們正在進入細胞療法的新時代,這本質上是首次將範圍擴展到淋巴細胞之外。”他補充道,“這些作者們證實他們能夠將一種惰性的非免疫細胞轉化為一種接觸依賴性的乳腺癌細胞殺手。”
典型的免疫療法是通過利用免疫係統的力量發揮作用的。比如,在CAR-T細胞療法中,患者接受他們自己的T細胞灌注,這些T細胞在體外事先已經過基因修飾而能夠識別癌細胞表麵上的一種特定蛋白,從而能夠摧毀這種癌症。論文通信作者、蘇黎世聯邦理工學院生物工程師Martin Fussenegger說,“但是,如果你通過調動你的內源性免疫係統對免疫細胞進行重編程來殺死癌症,那麽這可能導致一些副作用。”
【14】科學家發現能有效編程癌症免疫療法的關鍵開關蛋白!
DOI:10.1038/nature24993
在機體感染或腫瘤生長期間,一類名為CD8+ T細胞的特殊類型白細胞會在脾髒和淋巴結中快速增殖,並且獲取殺滅疾病細胞的能力;隨後某些殺傷性T細胞就會遷移到機體患處來消滅細菌或癌細胞。
那麽這些殺傷性T細胞如何學會離開“巢穴”後在特殊的組織部位(比如皮膚、倡導、實體瘤部位)積累的?長期以來研究人員並沒有有效闡明到底是哪種因素能促進T細胞超越淋巴係統的功能,以及在感染或癌症部位發揮作用,闡明這一點對於有效開發抗癌免疫新療法或許至關重要。
近日,一項刊登在國際雜誌Nature上的研究報告中,來自Scripps研究所和加利福尼亞大學的研究人員通過聯合研究發現,一種名為Runx3的特殊蛋白或能對殺傷性T細胞進行“編程”來幫其在腫瘤和感染位點建立“住所”。 Matthew Pipkin博士說道,在殺傷性T細胞中Runx3蛋白能對染色體發揮作用來以特殊方式編程基因,從而幫助T細胞在實體瘤中不斷積累。
【15】罕見免疫細胞影響癌症免疫治療效果
DOI:10.1126/sciimmunol.aan4631
特定類群的免疫細胞能夠抵抗機體紊亂的發生,這一類型免疫細胞功能的喪失將導致癌症的產生,因此大多數研究都集中在這些被稱為“效應T細胞”的免疫細胞亞群中。
然而,一項最新的研究則表明,效應T細胞發揮抗癌活性的背後或許有著更為深刻的細胞生物學機製。
因此,研究者們對一類被稱為“天然T細胞”的淋巴細胞亞群進行了研究,這類細胞並沒有分化成為效應T細胞。“患癌風險較高的群體不僅僅效應T細胞功能有一定障礙,而且他們的天然T細胞的活性也存在一定的缺陷”。該文章的作者,來自密歇根大學的教授Weiping Zou博士說道。
















 相關新聞
相關新聞