近幾年,免疫檢查點抑製劑在多種癌症類型中取得了驚人的治療效果,現已成為最前沿的癌症免疫療法之一。6月21日,Cell旗下Immunity雜誌(最新影響因子24.082)發表了題為“Resistance Mechanisms to Immune-Checkpoint Blockade in Cancer: Tumor-Intrinsic and -Extrinsic Factors”的綜述文章。
作者們總結了癌細胞自主因素、腫瘤微環境因素以及宿主相關因素如何在癌症治療時影響免疫檢查點阻斷療法,使其呈現出多樣化的響應。此外,文章還討論了免疫係統與宿主微生物群之間的互相關係能夠決定癌症治療響應的新證據。作者們提出了一個概念,即在使用免疫檢查點阻斷療法之前或治療期間調節腸道微生物可優化治療效果。
免疫檢查點療法進展回顧
過去十年中,癌症免疫療法前所未有的崛起和成功徹底改變了多種惡性腫瘤的臨床管理。其中,免疫檢查點阻斷劑(Immune-Checkpoint Blockers,ICBs)是免疫療法中最前沿的技術之一。這類療法在多種組織學腫瘤類型中具有廣泛的生物活性,且反應持久。根據目前的臨床結果,免疫檢查點阻斷療法中最成功的要屬靶向CTLA-4和PD-1/PD-L1的藥物。
引言中,作者們回顧了CTLA-4、PD-1/PD-L1抗體的作用機理和發展曆程。截止到目前(作者統計時),FDA批準的ICBs共4個,分別為,1)ipilimumab:CTLA-4單抗,用於治療不可切除或轉移性黑色素瘤;2)pembrolizumab:PD-1單抗,用於治療不可切除的轉移性黑色素瘤以及PD-L1陽性晚期轉移性非小細胞肺癌;3)nivolumab:PD-1單抗,用於治療不可切除或轉移性黑色素瘤、接受含鉑化療治療期間或治療後病情進展的晚期轉移性非小細胞肺癌以及晚期(轉移性)腎細胞癌;4)atezolizumab:PD-L1抗體,用於治療對含鉑化療不響應的局部晚期或轉移性尿路上皮癌。
然而,盡管這類抗體對癌症治療起到了很強的改善作用,但不可忽視的是,大多數患者未能響應ICBs,甚至因為免疫相關不良事件(immune-related adverse events,irAEs)的發生必須停止治療。對於ICBs來說,雖然一些數據證實了它前所未有的實力,但截止目前的臨床數據顯示,ipilimumab治療的患者響應率約為15%;而靶向PD-1/PD-L1的藥物治療的患者響應率很少超過40%,且其中有大量的部分應答。因此,有2個重要的問題需要解決:1)為什麽患者響應ICBs會產生一定程度的異質性;2)ICBs如何才能將覆蓋範圍擴展到多數癌症患者群體中?
為何產生耐藥性?
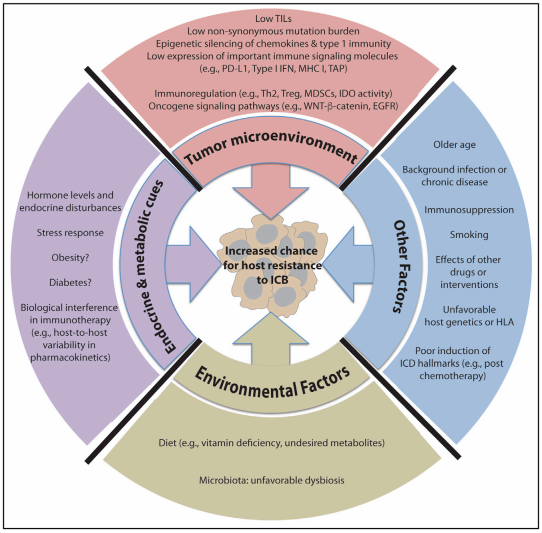
Major Factors Contributing to Primary Resistance to ICB Therapy(圖1)
作者們認為,從某種程度上來說,通過進一步深入理解和研究腫瘤微環境(tumor microenvironment,TME)中的免疫調節機製,這些問題的答案最終會浮出水麵。TME中有很多因素能夠抑製ICBs的治療活性,如Treg細胞、髓係來源抑製細胞(MDSCs)以及IDO(indole 2,3-dioxygenase)的活性;同時,一些腫瘤細胞自身因素也會影響ICBs的療效,包括突變負荷、致瘤信號通路、PD-L1的表達以及MHC-I類分子表達下調等。
事實上,腫瘤內在的因素並不是影響免疫療法結果的唯一因素(圖1)。一些新證據表明,癌症免疫療法還受到影響免疫係統功能的宿主相關和環境因素的影響。在這一綜述中,作者們匯總了這些較少被考慮到的、有可能決定免疫檢查點阻斷療法成敗的腫瘤外在(tumor-extrinsic)因素。同時,鑒於一些新的發現,他們特別注意到了腸道微生物群的免疫調節潛能。
正文中,作者們以大量的文獻分別從TME(第一部分)、癌細胞自發機製(第二部分)兩方麵解釋了免疫檢測阻斷療法的耐藥性。具體來說,TME部分相關的內容包括免疫調節通路、Th1和 Tc1趨化因子分泌的表觀遺傳沉默以及I型幹擾素信號的重要性;癌細胞自發機製部分介紹了致癌信號、突變狀態、炎症和代謝線索等內容。
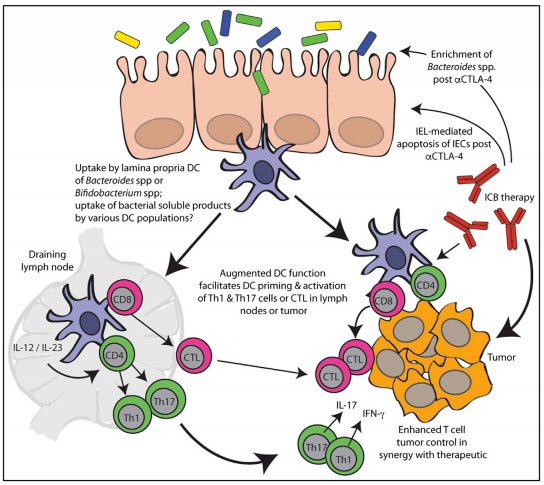
Immune-Checkpoint Blockade Mobilizes the Gut Microbiota to Promote Anti-tumor Immune Responses(圖2)
第三部分內容介紹了導致不良免疫療法響應的宿主相關因素,如年齡、HLA分型、遺傳多態性、飲食和新陳代謝以及慢性感染背景。第四部分內容中,作者們強調了腸道微生物組對成功的癌症免疫療法的重要性,分析了腸道微生物組對ICB免疫療法的影響,並稱它們可能與免疫療法引發的胃腸道毒性相關,未來有希望能夠通過進一步研究解決這一問題(圖2)。
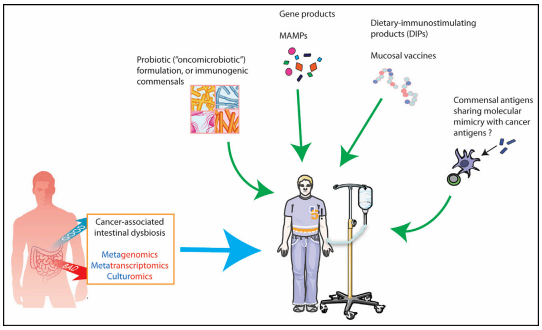
Mobilizing the Gut Microbiota to Circumvent Primary Resistance to ICB in Patients(圖3)
第四部分內容(圖3)匯總了改善免疫檢查點阻斷療法覆蓋範圍的新途徑。一方麵,作者們介紹稱,可以利用現有的治療手段幫助掃除免疫療法的障礙;另一方麵,他們再次強調可以通過操縱微生物組擴大ICB的治療範圍;此外,文章還提出了一種稱作“Oncomicrobiotics”概念。
結論
大量腫瘤或宿主相關的因素通過不同的方式組合決定了ICB抗癌療法臨床響應的異質性。近幾年,科學家們通過將ICBs結合各種輔助療法,改善其持久性、療效等屬性,以期降低這種異質性。其中,有很多途徑成功了,盡管通常毒性也會隨之增加。值得注意的是,操縱腸道微生物相關的成果極為引人注目。作者們還認為,飲食、益生菌或選擇性抗生素的管理以及特殊菌株(oncomicrobiotics)或其產物的補充應該被考慮為一種組合策略,用以支持腸道免疫力,刺激有效的抗癌免疫監視。














 相關新聞
相關新聞