hjc黄金城生物醫藥在仿製藥質量一致性評價方麵,已成功完成了多個質量一致性評價案例,具有仿製藥研發豐富的經驗,能夠為您提供更專業的一致性評價服務。
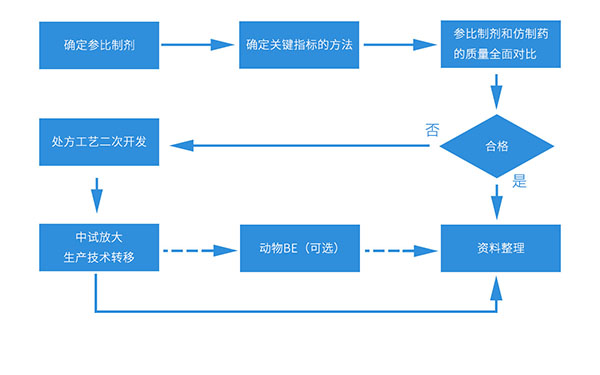
hjc黄金城仿製藥質量一致性評價綜合服務平台可以提供以下綜合服務:
一、參比製劑和仿製藥的質量全麵比對:
-
確定四條溶出曲線的測定條件,測定參比製劑和仿製製劑的溶出曲線,進行溶出曲線的比對;
-
確定有關物質、異構體等方法,測定參比製劑和仿製製劑的有關物質、含量、異構體等;
-
研究參比製劑和仿製製劑所用原料藥的晶型;
-
穩定性研究(包括影響因素、加速和長期);
二、處方工藝二次開發服務:
-
需更深入地研究原研製劑的質量;
-
對原料藥的性質進行充分的研究;
-
調整優化處方和工藝,並通過逐級放大確保處方工藝的耐用性;
-
中試放大/生產技術轉移;
-
質量研究
三、動物BE服務
本公司具有符合GLP資質的動物實驗室和檢測中心,可以用比格犬或食蟹猴等大動物進行動物BE實驗,為製劑的優化提供數據支持,降低臨床BE風險。
hjc黄金城仿製藥質量一致性評價中心的優勢
-
專業的工作背景,已成功向FDA和CFDA申報了多個仿製藥品種;
-
完整的質量保證體係,保證數據的準確性、真實、可追溯和完整性;
-
高效的工作流程,規範的操作標準,完善的方案和報告模板;
-
先進的儀器設備,包括光纖在線檢測自動溶出儀和符合GMP固體製劑中試車間等,保證項目完成的效率和時間;
-
擁有良好的臨床研究合作夥伴;
資訊內容如下:
2月29日,國務院食品安全辦公室主任、國家食品藥品監督管理總局局長畢井泉在國務院新聞辦舉行的發布會上表示:在過去的一年裏,食品藥品監管部門認真落實習近平總書記“最嚴謹的標準、最嚴格的監管、最嚴厲的處罰、最嚴肅的問責”的要求,認真貫徹落實黨中央、國務院工作要求和改革部署,以信息公開為突破口,增加食品藥品檢查、抽樣檢驗的範圍和頻率,嚴厲查處食品藥品領域的違法犯罪行為,在第一時間公開抽檢結果、公開檢查結果、公開案件查處結果,維護消費者權益,震懾違法犯罪,約束執法者的行為,發揮社會輿論的監督作用,促進了社會誠信體係建設。我們還積極推進藥品審評審批製度改革。提高了藥品的審批標準,按照與原研藥品質量、療效一致的原則對新申請上市的仿製藥進行技術審評,對已經上市的仿製藥開展一致性評價。簡政放權,提高效率,推進藥品上市許可持有人的試點,促進製藥工業由生產大國向質量強國轉變。
提高食品藥品監管透明度
據介紹,當前我國正處在食品藥品安全矛盾高發期,保障食品藥品安全,任重道遠。在新的一年裏,食藥監管部門將按照黨中央、國務院的要求,繼續加強市、縣兩級食品抽樣檢驗和生產經營企業、餐飲企業的日常檢查;整治農藥獸藥殘留超標和添加劑濫用等違法行為;切實加強標準的製定、法規的完善、藥品研發相關技術指導原則起草等基礎性工作;繼續加大對各類食品藥品安全違法犯罪的打擊力度;繼續做好檢查檢驗和案件查處信息公開工作;提高食品藥品監管透明度,增強公眾對中國製造食品藥品的信心;加快完善統一權威的食品藥品管理體製和製度,努力打造一支技術過硬、作風優良、勤政廉潔的職業化監管隊伍。
在食品方麵,新修訂的《食品安全法》2015年10月1日起正式開始實行。目前,國家總局已經製定發布了和正在製定一些配套的規章,確保切實把法律規定的內容執行到位。
同時,將進一步加強如嬰幼兒配方乳品等重點領域的監管,如對嬰幼兒乳粉的抽驗,從去年每個季度抽樣檢驗公布一次改成“月月抽檢、月月公開”,還要繼續加大生產體係的檢查力度,嚴格控製嬰幼兒配方乳粉配方的數量和品牌,禁止利用配方進行誇大宣傳、誤導消費者。
此外,在加強對生產企業、銷售企業日常監督的同時,鼓勵企業按國務院文件要求建立產品追溯體係,確保產品的源頭可追溯。
畢井泉說,企業是食品藥品研發和生產的主體,應當承擔起保障質量安全的主體責任,應當承擔起建設產品追溯體係的主體責任。
據悉,此前熱議的電子監管碼問題也將得到妥善解決。在今後政策措施的製定時,充分考慮其經濟性、有效性、公平性、合法性,充分聽取社會各界的意見,取得監管對象的理解、配合和支持。
藥品審評審批提質增效
據介紹,藥品審評積壓是國家總局目前麵臨的一個比較艱巨的任務,藥品審評積壓最高的時候曾經達到32000多件,經過一年多的努力,去年藥品審評中心審評完成的數量比2014年增加了90%,藥品審評積壓的數量大幅度下降。
2月26日,國家總局發布《關於解決藥品注冊申請積壓實行優先審評審批的意見(食藥監藥化管〔2016〕19號)》以進一步加強藥品注冊管理,加快具有臨床價值的新藥和臨床急需仿製藥的研發上市,解決藥品注冊申請積壓的矛盾。
據悉,下一步將建立藥品上市申請人與藥品審評人員的會議交流製度,實施對罕見病及其他特殊病種等減少臨床試驗病例數,以及對治療嚴重危及生命的疾病無有效治療手段的新藥允許在Ⅲ期臨床前有條件的批準上市等一係列措施,鼓勵新藥加快上市。
此外,對於國內缺乏且臨床急需的兒童用藥,國家總局設立了申報審評的專門通道,加快審評。1月29日,國家總局專門發布了《關於臨床急需兒童用藥申請優先審評審批品種評定基本原則及首批優先審評審批品種的公告》,進一步細化了相關政策,鼓勵企業研發上市適合兒童使用的藥品以及研發兒童專用劑型和規格。
明確一致性評價時間節點
據介紹,2月20日,國務院辦公廳正式印發《關於推進仿製藥質量和療效一致性評價的意見》(以下稱《意見》),《意見》明確:企業是仿製藥一致性評價的主體,應主動選購參比製劑開展相關研究,按規定的方法研究和進行臨床試驗,確保產品質量和療效與參比製劑一致;政府要統籌協調產品參比製劑的確認、評價方法和資料申報、評價,以及對仿製藥一致性評價工作加強指導。同時,對通過仿製藥一致性評價工作的藥品在臨床使用和醫療保險方麵給予政策上的支持。
同時,《意見》還明確要求:國家基本藥物目錄(2012年版)中2007年10月1日前批準的化學仿製藥口服固體製劑,應在2018年底完成一致性評價,逾期未完成的不予再注冊。對其他已批準上市的藥品,自首家品種通過一致性評價後,其他生產企業的相同品種在3年內仍未通過評價的,注銷藥品批準文號。
畢井泉說,這對企業來說也是一個巨大的挑戰,但是這項工作對提高製藥工業的發展質量,對於真正把我國製藥工業由製藥大國轉為製藥強國,真正使我們所生產的製劑藥品能夠走向國際市場,都是至關重要的。
強大的監管才能造就強大的產業。食品藥品企業既是食藥監管部門的監管對象也是服務對象。各級食藥監管部門要寓監管於服務之中,以有效的監管製度創新服務於產業的發展創新,推動食品藥品產業的供給側結構性改革,夯實食品藥品安全的產業基礎。食品藥品是民生問題,也是社會問題,希望社會各界積極參與食品藥品監管工作,推動食品安全社會共治,同各級食藥監管部門一起努力,共同維護好廣大人民群眾“舌尖上的安全”。
















 相關新聞
相關新聞