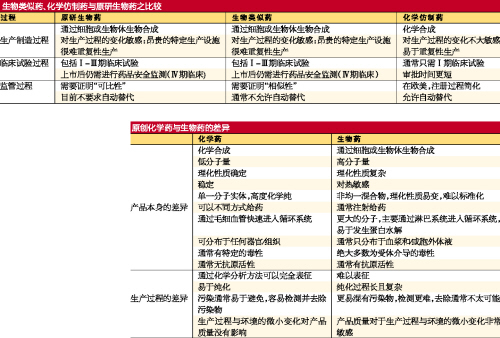
生物類似藥和化學仿製藥雖然都有著共同的目標——治病救人,並且都屬於仿製藥類別,但兩者顯著不同。相比於化學仿製藥,生物類似藥主要有“兩高”的特點:即技術門檻高、投資門檻高。
一般認為,生物類似藥研發通常需要8~10年,比化學藥仿製藥的3~5年要長很多。世界最大的仿製藥公司之一、著名跨國藥企諾華旗下的山德士認為一種典型的化學仿製藥的仿製成本為200萬~300萬美元,而生物類似藥的這一數字則高達0.75億~2.5億美元,兩者相差百倍。
盡管研發所需的時間和金錢成本在不同的報道中有所不同,但沒有爭議的是:生物類似藥比化學仿製藥所需時間更長,投資成本更高。而上述的不同,是由於兩類藥的諸多不同造成的,本文就力圖探討兩者的不同之處。
[PK篇]
原研生物藥、生物類似藥、化學仿製藥之全方位比較
要想了解生物類似藥和化學仿製藥的差異,首先需要弄清楚原研生物藥和化學藥的差別,筆者以列表方式係統總結了兩者的差別。筆者還列表總結了生物類似藥和化學仿製藥的主要區別。
產品本身PK
小分子化學藥通常是化學合成的,而大分子生物藥則通常是生物合成的。兩者在源頭的不同,直接導致兩者在結構、成分、生產方法和設備、知識產權、配方、保存方法、劑量、監管方式以及銷售方式均有不同。
與合成的小分子化學藥相比,生物藥在分子大小上要大百倍至上千倍。比如抗體藥分子量高達15萬道爾頓,而化學藥分子量通常不到1000道爾頓。有的報道將小分子化學藥的大小比作一輛自行車,而生物藥的個頭則相當於一架飛機。
其實,兩者的區別不僅僅是分子大小的差別,更重要的是生物藥的分子結構要遠比化學藥複雜。比如蛋白類藥,有一級結構(氨基酸序列)、二級結構(如α螺旋、折疊等)以及更複雜的三級結構。有些生物藥,蛋白分子間三級結構的穩定結合還會形成四級結構。
更為複雜的是,在生物合成後這些生物藥的結構通常會有翻譯後修飾(即PTM),包括糖基化、磷酸化等。而這些修飾,不同批次的生物藥也會不盡相同。這些變化對於生物藥的生物活性可能是很關鍵的。
生物藥和化學藥的另外一個重要區別是它們的免疫原性,幾乎所有的治療性蛋白都會在人體內產生抗體。它們會通過中和內源性因子而降低活力甚至誘發嚴重的副作用。
盡管生物藥和化學藥的不同點很多,但筆者認為最核心和最重要的區別有兩點,這也是對於生物藥而言必須同時至少具備的兩個條件:生物體合成和大分子。有些小分子化學藥也可以采用生物合成方法;而現在的多肽合成技術可以化學合成高達超過100個氨基酸,分子量可以上萬道爾頓,但是即使是這麽大的多肽(或者說是小蛋白)也算不上生物藥。
生產過程PK
由於生物藥有更大的分子量和複雜的結構,生物藥的表征麵臨很大的挑戰。盡管隨著現代科技的進步,分析表征生物藥的技術手段越來越先進,但是由於上述的特點,即使全世界可能有的最先進的儀器設備全用上,也不可能將生物藥的結構等特性完全表征清楚。這些特點也注定生物類似藥不可能完全和原研藥一模一樣,即使是同一家公司生產的同一種生物藥,不同批次也會有差異,即使是同一批次,在儲存、流通的過程中,生物藥(尤其是蛋白類藥物)的結構和活性也不可避免地會有所變化。
對於生物類似藥生產商而言,由於知識產權保護等多種原因,原研藥公司所采用的生產工藝甚至是所采用的細胞係都會不清楚,這就更導致生物類似藥與原研藥不會一樣。
另外,生物藥的生產及流通過程更加複雜,要求也更高,有許多步驟,細胞培養的條件(溫度和營養)、產品的加工、純化、儲存和包裝等各個環節都會影響產品的生產,整個過程中的微小差別都可能會對最終產品的質量、純度、生物特性以及臨床效果產生較大的影響。正由於上述種種原因,雖然化學仿製藥的英文是generic drug,但生物類似藥並非biogeneric,而是biosimilar,因為生物類似藥隻可能與原研藥“相似”(similar),絕無可能一樣。
然而對於傳統的小分子化學藥而言,一般都有非常確定而且穩定的化學結構,現有的分析方法(比如紅外、核磁共振、X-射線衍射、質譜等)足以將其化學結構完全搞清楚。
降價空間PK
所以,總的來說,生物藥的生產對於其生產條件的要求遠比化學藥苛刻,當然生產成本也更高。而且,生物藥的臨床前和臨床階段的研發成本也更高,因為監管機構(尤其是在歐美)要求生物類似藥生產商提供足夠的臨床數據充分證明生物類似藥和原研藥有一樣的臨床療效,這也導致生物類似藥在獲批上市前的仿製成本往往是化學藥的上百倍。
也正是由於生物類似藥高昂的仿製成本與生產成本,一般生物類似藥和原研藥相比,隻能降價10%~30%,而化學仿製藥則可高達80%甚至更高(這一點對於印度製造的化學仿製藥尤其如此)。因此,化學原研藥一旦專利過期,就會受到仿製藥的猛烈衝擊,銷售額會大幅度下降,而化學仿製藥也會很快搶占市場(這一點,此前的“藥王”立普妥Lipitor就是明證);而生物原研藥則在專利過期後,銷量受仿製藥的影響較小。
監管政策PK
生物類似藥和化學仿製藥的區別還反映在上市後的監管上。由於化學仿製藥與原研藥結構相同,且結構簡單,歐美監管機構允許藥劑師自主用化學仿製藥替換原研藥(即:自動替換政策,或可替換,interchangeability),無需通知開處方的醫生。而對於生物類似藥,在歐盟,法規明確要求不允許自動替換。就目前美國FDA已經正式發布的有關生物類似藥的指南來看,biosimilar又可以分為兩類: 一是與原研生物藥高度相似的普通biosimilar;二是interchangeable biosimilar。
可以自動替換的生物類似藥,即interchangeable biosimilar,比普通生物類似藥要求更為嚴格。迄今為止,FDA才批準了1個生物類似藥,且不允許自動替換。筆者預計,至少在未來的3~5年很難有可自動替換的生物類似藥在美國獲批上市。
對於自動替換政策,筆者認為有必要多說幾句:interchangeable其實如果翻譯成自動替換就會造成歧義,其實interchangeable並不是自動化係統真的“自動”替換的,而是根據美國的法規,藥店或醫院的藥劑師可以根據自己的知識和經驗來判斷處方藥是否可以替換。以美國生物類似藥的“獨苗”——2015年3月批準的山德士的Zarxio(filgrastim-sndz)為例,如果一名美國醫生開的處方是安進的Neupogen,藥劑師就不能自作主張用Zarxio來替換,因為Zarxio不是interchangeable biosimilar。而如果Zarxio是interchangeable biosimilar,藥劑師則可以不用知會開處方的醫生就可以用Zarxio來替換Neupogen。如上所述,迄今為止FDA尚未批準任何一種interchangeable biosimilar。
由於生物藥的高度複雜性,生物類似藥能做到與原研藥高度類似已經很不容易,因此,要做到與原研藥一樣的可替換的生物類似藥,難度不是一般的大。達到什麽樣的標準才算interchangeable biosimilar?目前FDA尚未出台明確的指南,相信出台這樣的指南也不是一件容易的事。
[市場篇]
我國在研儲備全球第一,未來10~15年是黃金期
相較於化學藥,更加複雜並且通常也更加昂貴的生物藥進入市場無疑麵臨更大的挑戰,尤其是對於低收入水平的發展中國家而言。
目前在中國,本土生物藥(絕大多數是所謂的第一波生物類似藥,如幹擾素、生長因子等)在總的藥物市場所占比例較小,而在歐美,獲批的創新生物藥數量近幾年基本占獲批新藥總量的三成左右(在美國,如果算上FDA下屬CBER批的生物藥,這個比例更高一些)。
生物藥價格一般更高,也促進生物藥市場份額不斷快速上升。就全球而言,目前生物類似藥還基本處於起步階段,生物類似藥目前所占市場份額可以說還微不足道。但是,業界普遍認為,未來10~15年是生物類似藥的黃金發展期。據IMS Health預測,至2020年,生物類似藥的年銷售額有望達到250億美元,約占生物藥市場份額的10%。
麵對如此大的蛋糕,我國作為仿製藥大國,有條件的國內藥企自然要上馬生物類似藥,沒有條件的也是想方設法要上。所以,現在我國在研生物類似藥數量(主要是臨床前階段)已經超過美國,成為全球第一(據湯森路透數據)。
這麽多生物類似藥,如果隻靠中國市場,顯然消化不了,進軍歐美國際市場相信會是中國本土一些有實力藥企的必然選擇。但是,歐美尤其是全球藥品第一大市場美國對生物類似藥的監管非常嚴格,所以中國藥企都知難而退。尤其是難度最大含金量也最高的單克隆抗體的生物類似藥,迄今沒有一個來自中國的單抗生物類似藥在美國開始臨床試驗(獲批BLA),整個大中華地區也隻有台灣的喜康(JHL)拿下歐洲,率先在歐洲開始臨床試驗自己的rituximab生物類似藥(即利妥昔單抗)JHL1101。















 相關新聞
相關新聞