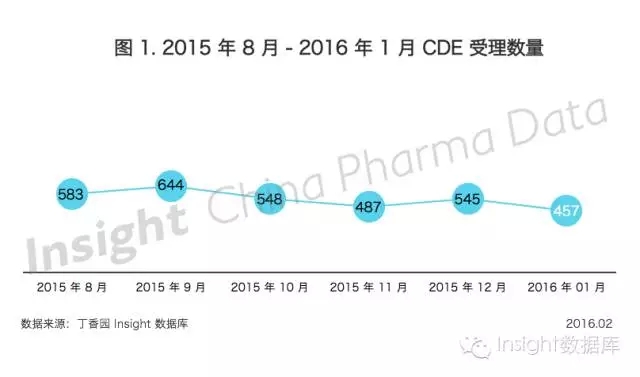
根據丁香園Insight -China Pharma Data數據庫最新統計, 2016年1月CDE 共承辦新的藥品注冊申請有432個(以受理號計,下同)。
自8月藥品審評審批政策改革以來,2016年1月申報受理數量達到最低穀,隻有457個,比2015年同期少了將近200個受理號。
以下,分別來分析2016年1月化藥、中藥、生物製品的申報受理及審評審批情況。
申報受理情況
一、化藥
1月藥品申報受理數量為近一年最低
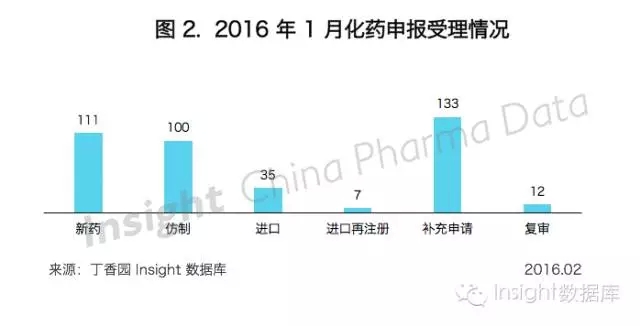
Insight 數據庫顯示,2016年1月份CDE共承辦新的化藥注冊申請以受理號計398個,也是近一年來化藥申報數量的最低峰。
1、 新藥
(1)1.1 類新藥
軍事醫科院抗抑鬱新藥阿姆西汀申報臨床
根據 Insight 數據庫統計,1 月份 CDE 共承辦化藥 1.1 類新藥申請以受理號計有 15 個,涉及 4 個品種,均為臨床申請。
具體數據如下所示:

天津尚德的 ACT001 是一種抗腦膠質瘤新藥,並進入了 2016 年國家「重大新藥創製」複審名單。
卡南吉醫藥由上海張江科技創業投資有限公司投資,其酪氨酸激酶抑製劑CM082片此次臨床申報已是第三次,正在進行中的I期臨床試驗適應症涉及濕性年齡相關性黃斑變性、腎癌和晚期惡性腫瘤等。
繼上海艾力斯成功研製 AngII 受體拮抗劑艾力沙坦之後,上海艾力斯的 1.1 類新藥研發線上還有 EGFR/HER2 抑製劑甲苯磺酸艾力替尼和糖尿病藥物艾格列淨等。
今年年初,上海艾力斯申報臨床的藥品中又增加了甲磺酸艾氟替尼,但不確定艾氟替尼是否是2008年就申報過的甲磺酸艾力替尼。
軍事醫學科學院於1月申報的阿姆西汀是一種通過 5-HT/NE 雙重重攝取抑製劑 (SNRIs) 度洛西汀結構改造得的全新手性化合物,其抗抑鬱作用強於現有的 SNRIs。
2014年,石藥集團(HK:01093)與軍事醫學科學院簽訂協議,以4200萬人幣獲得了獲得阿姆西汀在中國的專利權、開發權和經營權,以及中國以外專利的優先受讓權。根據 Insight 數據庫,目前神經係統類用藥占石藥產品線約12%的權重,阿姆西汀將助力石藥繼續拓展神經係統領域產品線。
(2)3.1 類新藥
國內首次搶仿 3.1 類新藥數量依然掛空
2016年1月份CDE 共承辦新的化藥3.1 類新藥申請以受理號計有85個,全部都為臨床申請,涉及34個品種。
根據 Insight 數據庫的潛力品種篩選係統,1月國內依然沒有首次申報的3.1類新藥品種。
2、仿製
2016 年1月份,CDE共承辦化藥仿製藥新申請以受理號計有100個,涉及66個品種,申報數量繼續下降。
3、進口化藥
新基與Agios合作的AML新藥AG-221首次在中國申報臨床
2016年1月份,CDE共承辦新的化藥進口注冊申請以受理號計有35個,相比12月的增長趨勢,新年第一個月進口化藥申報數量有所下降,但與去年同期基本持平。
其中,臨床申請有27個,上市申請有8個,所有申請共涉及24個品種。
1 月,兩個進口化藥品種在中國首次申報,一個是新基製藥與 Agios 製藥合作開發的AG-221,該藥物被 FDA 授予了快速通道審評資格,用於治療異檸檬酸脫氫酶-2(IDH2)突變的急性骨髓性白血病 (AML) 患者。
另一個是他氟前列素馬來酸噻嗎洛爾滴眼液,原研企業參天製藥終於在1月申報了該複方製劑,而早在2014年11月,江蘇恒瑞已經申報了他氟前列素馬來酸噻嗎洛爾的臨床申請。
參天製藥的他氟前列素滴眼液幸運地避開了722自查核查於2015年7月獲批上市,不知道其複方製劑將來是否也能幸運地避開與首仿企業的市場爭奪。
二、中藥
1月份CDE共承辦中藥新申請以受理號計有29個,其中新藥申請2個,補充申請24個,複審、進口再注冊和仿製1個。
比起每月隻有個位數的中藥新藥申請數量,2015年一年就批準上市了90餘個中藥新藥實在讓人匪夷所思。
三、生物製品
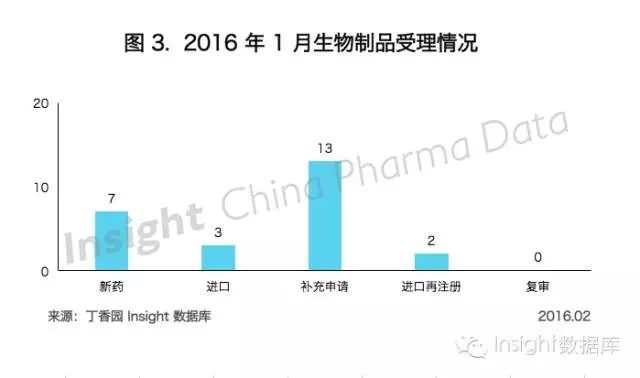
1月份CDE共承辦生物製品新申請以受理號計有25個,與上個月持平。
具體申報情況如下所示:
審評審批情況
1、總體審評情況
CDE完成審評932個,其中企業撤回216個
根據 Insight 數據庫高級篩選,1月有932個受理號完成審評(即進入審批階段或已有審評結論),包括 2016 第 21 號公告中企業撤回的 199 個受理號以及推測企業撤回的 17 個受理號,也就是說,CDE在1月實際完成審評的數量為 733 個。
2、 1.1 類新藥審批情況
1月 20 個 1.1 類新藥獲批臨床
根據 Insight 數據庫統計,獲批臨床的 1.1 類新藥共有 20 個,涉及 49 個受理號。
從去年年底開始,1.1 類新藥審評明顯趨於集中,上個月發了 19 個品種臨床批件,1 月份這個數量為 20 個。
除了審評集中,審評時限也在提速,1 月批準臨床的 1.1 類新藥平均審評時限為 15 個月。
具體數據如下所示:

3、 1類生物製品審批情況
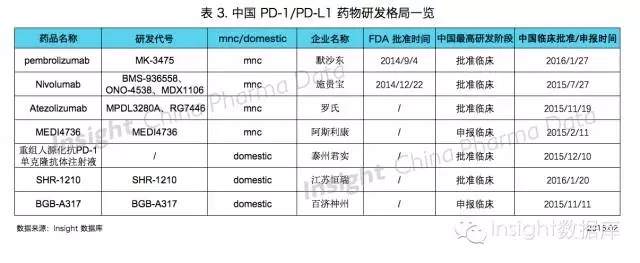
江蘇恒瑞 PD-1 藥物獲批臨床,緊追君實
審評審批方麵,生物製品辦理狀態進入審批階段的受理號共 127 個,其中企業撤回 8 個。
上個月泰州君實的抗 PD-1 藥物剛獲批臨床,緊接著 1 月 20 日江蘇恒瑞的抗 PD-1 藥物 SHR-1210 也獲得臨床批件,趕上了君實的進度,進入你追我趕的焦灼局麵。
以下是中國 PD-1/PDL-1 的研發格局:



















 相關新聞
相關新聞