
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




隨著我國藥品監測網絡覆蓋麵的逐年擴大,及發現和搜集藥品不良反應信息能力的增強,近5年,我國ADR報告總數持續上升,2010-2014年我國藥品不良反應監測中心累計收到的報告數量約達540萬份。而從具體的藥品來看,盡管抗感染類、中藥注射劑等類別與劑型都是這些年來發生不良反應的“重災區”,但數據也反映出,這些類別的不良反應正得到重視,整體的用藥安全狀況也趨向改善狀態。
整體:監測覆蓋麵逐年擴大
從2010-2014年全國藥品不良反應監測網絡中心收到的數據報告來看,我國ADR報告份數保持持續、穩定的增長趨勢。2014年,我國收到的藥品不良反應/事件報告共有132.8萬份,較2013年增長了0.8%;2013年,我國ADR報告總數達131.7萬份,較2012年增長了9%;2012年的報告總數為120餘萬份,較2011年增長40.71%;2011年報告總數超85萬份,較2010年增長23.08%;2010年報告總數逾69萬份,較2009年增長8.4%(見圖1)。
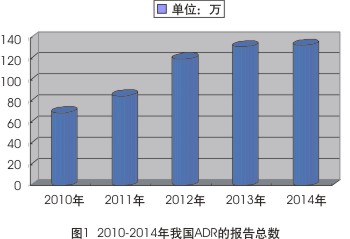
2010-2014年我國ADR的報告總數
同時,曆年來,新的和嚴重藥品不良反應/事件報告一直是藥品不良反應監測的重點,新的和嚴重報告比例,尤其是嚴重報告比例是衡量總體報告質量和可利用性的重要指標之一。數據顯示,2014年全國藥品不良反應監測網絡收到新的和嚴重藥品不良反應/事件報告達34.1萬份,與2013年的29.1萬份相比增長了17.0%;較之2010年的10.9萬份,增幅達212%(見圖2)。
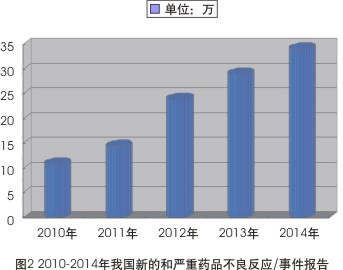
2010-2014年我國新的和嚴重藥品不良反應/事件報告
總數的上升,得益於我國在藥品不良反應監測能力上的提升。據了解,2010年,我國藥品不良反應監測網絡在線基層用戶僅有4萬餘個;到2014年,全國已有24萬餘個醫療機構、藥品生產經營企業注冊為藥品不良反應監測網絡用戶,並通過該網絡報送藥品不良反應報告。
而這24萬餘個“用戶”所覆蓋的範圍,也遠超國際指標。按照世界衛生組織的推薦,每百萬人口的平均報告數量應達到200-400份;而我國此前出台的《藥品安全“十二五”規劃》提出的目標也是,每百萬人口平均報告數量應達到400份——2013年,此數據就達到了983份。而2014年,全國每百萬人口平均報告數量達到991份,與2013年相比增加了0.8個百分點,超出十二五既定目標約2.4倍;同時,2014年全國藥品不良反應/事件縣級報告比例為94.4%,與2013年相比增長了0.6個百分點。
更深入來講,在我國總體用藥規模呈現不斷增長的態勢下,無論是報告數量的上揚、報告質量的提高,還是藥品安全監測覆蓋麵的擴大與監管網絡的發達,都在顯示著我國發現和收集藥品不良反應信息的能力正進一步增強。
實際上,自2011年7月開始實施新的《藥品不良反應報告和監測管理辦法》後,新的國家藥品不良反應監測係統於2012年隨即全麵投入使用,由此監測係統的預警、統計和分析功能得以大大加強。
首先,這有賴於國家藥監部門數據評價分析能力的提高。以2014年全國藥品不良反應監測工作為例,國家藥監部門通過日監測、周匯總、季度分析等方法加強對國家藥品不良反應監測數據庫數據的評價分析,深入挖掘藥品風險信號,對阿德福韋酯、胞磷膽堿鈉、苯溴馬隆等近50個(類)品種進行了安全性評價,並采取了相應的風險管理和溝通措施。
其次,近年來我國藥品安全監測預警能力也同樣得到重視。2013年的ADR報告指出,國家藥品不良反應監測係統功能已實現了實時數據分析和藥品風險預警管理,建立了國家和省兩級信息共享、高效聯動的不良反應/事件預警機製;2014年,藥品聚集性事件預警平台得以進一步完善,藥監部門建立預警信息全國共享、事發地和生產企業所在地食品藥品監管部門協同調查處置聯動工作機製,保證藥品質量風險的早發現、早評價、早控製。
據了解,2014年全年共有137條預警信息得到重點分析評價,在數量上相較於2013年的61條上漲了一倍多。同時,2014年還及時發現並處置了湖北同濟奔達鄂北製藥有限公司核黃素磷酸鈉注射液、安徽聯誼藥業股份有限公司胞磷膽堿鈉注射液、吉林省集安益盛藥業有限公司生脈注射液等多起因藥品質量問題引發的不良事件,有效保障公眾用藥安全。
品類:抗感染類占比下降
具體到藥品品類上來,在2010-2014年的ADR報告中,化學藥類不良反應的報告數均占“大頭”,基本維持在80%以上。以最新的2014年數據為例,化學藥在ADR報告總數中占了81.2%,而中藥與生物製品分別占17.3%及1.5%(見圖3)。
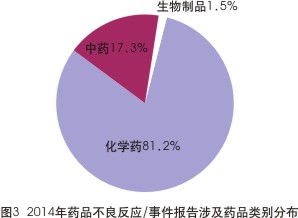
其中不得不提到的是,一直以來“霸占”著ADR報告榜首的抗感染藥。2014年,全國藥品不良反應監測網絡共收到抗感染藥物的不良反應/事件報告50.6萬例,占報告總數的38.2%,其中嚴重報告2.4萬例,占4.8%。
但分析2010-2014年的數據則可發現,抗感染藥在整份ADR報告中所占的比例已連續5年出現小幅下降趨勢——2010年該類藥品不良反應占化學藥53.6%,到2014年此數據已經下降至46.2%(見圖4)。
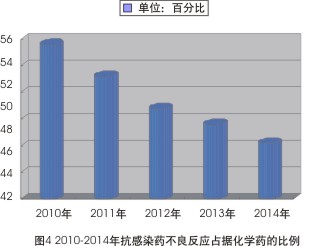
同時,近年來,ADR報告中涉及的抗感染藥構成情況也趨於穩定。2014年的ADR報告就涉及了9大類、328個品種,其中抗生素病例報告占66.7%,其排名前5位的是頭孢菌素類(32.3%)、大環內酯類(10.7%)、青黴素類(9.7%)、β-內酰胺酶抑製藥(5.6%)林可黴素類(3.8%);合成抗菌藥病例報告占24.5%,其中主要是喹諾酮類(18.0%)和硝基咪唑類(5.6%)。此藥品構成比與2013年的ADR報告並無明顯差異。
對此,業界普遍認為,抗感染藥不良反應報告總數持續下降,主要是由於我國對該類藥物的風險控製取得了一定的成效。早在2012年,衛生部門就已發布《抗菌藥物臨床應用管理辦法》,以加強抗菌藥物的合理使用,限製了抗菌藥物的使用比例;同時,近年連續開展的“抗菌藥物專項整治活動”,也使得各級醫療機構、醫務人員愈發重視抗感染藥的合理使用,各相關部門也不斷加強該類藥物不良反應的監測與救治工作,降低其使用風險。
然而,盡管抗感染藥用藥安全整體情況趨好,但仍需要注意的是,臨床使用量大、易導致藥物過敏等不良反應的頭孢類、青黴素類、喹諾酮類等藥物,臨床使用情況依舊存在不合理現象。實際上,2010-2014年,不良反應報告/事件排名前幾名的抗感染藥,基本都“落”在頭孢菌素類、喹諾酮類、大環內酯類、青黴素類、β-內酰胺酶抑製劑類等類別上,左氧氟沙星、頭孢曲鬆、頭孢呱酮舒巴坦等品種也是不良反應名單中的“常客”。
另外,隨著近年來行業對兒童用藥安全關注度的上升,2014年ADR報告與其他年份不同的是,其在用藥安全提示中特別指出,要關注兒童抗感染藥用藥安全。據了解,2014年共收到兒童藥品不良反應12.2萬份,其中由抗感染藥引起的不良反應報告就有7.8萬餘份,占比超過60%。
該報告指出,與總體人群相比,兒童使用抗感染藥嚴重報告比例較低,涉及的抗感染藥類別、品種排名以及不良反應表現與總體人群相比有所差異,其中阿奇黴素、炎琥寧、頭孢硫脒、紅黴素的風險相對突出,應引起關注;從引起的不良反應表現來看,胃腸道損害較為突出,口服給藥更容易導致兒童胃腸道損害的發生。男性兒童使用抗感染藥的不良反應發生構成比高於女性兒童,這可能與兒童原患疾病的發病率相關。從不良反應報告涉及的患者年齡分布上看,呈現出年齡越小,不良反應報告比例越高的趨勢,即年齡越小,發生不良反應的風險越高。
劑型:中藥注射劑風險仍高
在劑型上,中藥注射劑則無疑是藥品風險高發的“地帶”。眾所周知,此劑型之所以存在較高風險,除了注射是最危險的用藥方式之一外,主要與該類產品本身的特點有關——中藥本身成份複雜,產業鏈較長,影響質量的因素較多,就加大了中藥注射劑的不良反應概率。
因而,整體來說,隨著臨床使用量的增加,在近年的ADR報告中,中藥注射劑的安全狀況基本與全國整體情況保持一致,在數量上呈平穩增長趨勢。
2010年的ADR報告盡管沒有說明中藥注射劑不良反應的報告數,但也從劑型的角度指出,在2010年中成藥的嚴重報告中,中藥注射劑占比高達87.2%,此占比率較之於2009年增長了3.1%,而2011年,全國共收到中藥注射劑報告超6.5萬餘次;2012年,中藥注射劑不良反應報告達10.3萬例次;2013年、2014年該數據分別達到12.1萬例次、12.7萬例次(見圖5)。同時,該類產品嚴重報告數量也在持續增長,占比從2012年的5.3%上升到2014年的6.7%。
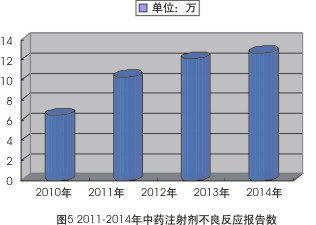
而對於中藥注射劑這一不反應重災區,曆年來的ADR報告都警示:其與其他藥品聯合使用現象依然普遍存在,有可能增加安全風險。分析2014年中藥注射劑總體報告排名前20位藥品(占全年中藥注射劑報告88.7%)合並用藥情況就可發現,涉及合並用藥的報告占42.3%,嚴重報告涉及合並用藥占57.0%。
因此,2014年ADR報告與此前的報告一樣,提醒臨床醫師須注意單獨使用中藥注射劑,禁忌與其他藥品混合配伍使用;謹慎聯合用藥,如確需要聯合使用其他藥品時,應慎重考慮藥物相互作用以及與中藥注射劑的間隔時間、輸液容器的清洗等問題。
此外,隨著醫改的推進,基層醫療市場快速發展,基藥的推行和國家對各級醫院基藥使用比率的要求明確,中藥注射劑在基層有著巨大的發展空間的同時,也凸顯該市場領域用藥安全隱憂。
這與基層的醫療環境有關。一方麵,基層缺乏先進的診斷設備,比如注射液使用的溫度、濕度等等條件,基層醫院受限於經費等問題不能達到要求;另一方麵,基層醫生素質和知識水平有限,在臨床診斷過程中容易發生不合理用藥現象。同時,一旦出現不良反應事件,基層醫院與醫生往往缺乏及時良好的救治方法及突發事件的應急經驗,進而“推高”了不良反應的發生率。
從2014年中藥注射劑病例報告數量排名前20名藥品的用藥單位情況就可看出,基層醫療衛生機構(含衛生院、衛生所、個人診所等)使用中藥注射劑發生不良反應報告多於其他醫院報告。例如,清開靈注射劑相關的不良反應報告有75%來自基層衛生醫療機構。
因而,2013年與2014年的ADR報告,均提示關注基層醫療機構中藥注射劑使用安全。2014年的報告指出,使用中藥注射劑的醫療機構應完善配備緊急救治基礎設備,加強醫務人員應急處置能力的培訓,準確掌握使用中藥注射劑患者的情況,發現可疑不良事件要及時采取應對措施。藥品生產企業應加強合理使用中藥注射劑的宣傳與培訓,注意完善藥品說明書,告知產品不良反應信息、禁忌與注意事項,有效控製藥品使用風險。
警惕:關注老年用藥安全
在2010-2014年的ADR報告中,除了上述幾近於“例牌菜”的抗感染藥、中藥注射劑等不良反應重災區一直受到關注外,近兩年的報告都在提示老年人的用藥安全問題。
這主要是由於,老年人在生理、心理方麵均處於衰退狀態,給用藥安全帶來隱患。在生理方麵,老年人肝腎功能退化,藥物吸收、分布、代謝和排泄均受影響,不良反應發生率升高;老年人往往身患數病,經常多種藥物同時使用,容易發生藥物相互作用。有臨床資料表明,服用5種以下藥物不良反應發生率在6%-8%,服用6-10種藥物不良反應發生率將增至40%。同時,在心理方麵,老年患者安全用藥常識相對缺乏,自我風險管理能力較弱;很多老年患者求醫心切、用藥依從性較差,容易出現不合理用藥情況。
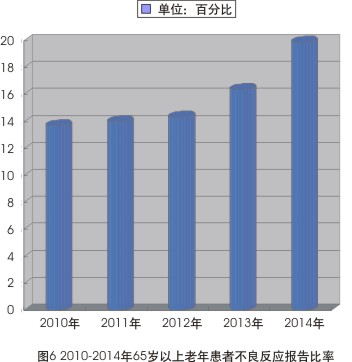
2010-2014年ADR報告的年齡分布也顯示,65歲以上老年患者的不良反應報告比例已從2010年13.7%的占比上升至2014年的19.9%,連續5年呈現小幅升高態勢(見圖6)。尤其是在嚴重報告中,65歲以上老年患者報告比例更高, 2014年此比例達到27.3%。
從另一個數據也能佐證老年人用藥安全狀況的嚴峻。這就是,常見於老年患者的心血管係統用藥不良反應的報告數近年來也在不斷增加。在近5年的化學藥不良反應報告中,心血管係統用藥所占比例僅次於抗感染藥,2010-2014年此比例分別為7.8%、8.5%、9.6%、 10%、10.2%,呈逐年上升的態勢。
可以預見的是,在我國老年化愈發明顯的態勢下,老年用藥的不良反應還將會隨之更為突出。因此,按照2014年ADR報告提醒的,老年患者使用藥品盡量做到用藥個體化、減少藥品種類、注意給藥途徑和時間、加強用藥前和用藥期間監護與監測,尤為必要。同時,對於生產及經營企業而言,在將老年用藥推向市場的過程中,也要加強醫生與患者的臨床教育工作。
 相關新聞
相關新聞