Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




一 總局關於發布仿製藥參比製劑目錄的通告
自2016年11月4日仿製藥質量和療效一致性評價工作平台參比製劑備案模塊正式上線運行以來,參比製劑備案有序進行,但卻一直不乏有企業存在變更參比製劑的情況,在參比製劑的選擇上許多企業都不盡如意。2017年4月28日,經國家食品藥品監督管理總局仿製藥質量與療效一致性評價專家委員會審核確定,對外發布了第三批,第四批仿製藥參比製劑目錄(第三批參比製劑目錄通告鏈接:http://www.sda.gov.cn/WS01/CL1751/172151.html;第四批參比製劑目錄通告鏈接:http://www.sda.gov.cn/WS01/CL1751/172152.html)。參比目錄一出,又有一大波企業抓狂,表示參比製劑選錯了,對於那些剛剛根據《關於發布企業提交參比製劑備案變更程序的通知》(詳情鏈接:http://www.nicpbp.org.cn/fzy/CL0843/9293.html)走完參比製劑變更流程的企業來說更是無語。
二 原研製劑的標杆和榜樣指導作用
原研製劑是仿製藥研發的“標杆和榜樣”,仿製藥需要保證與原研藥的體內生物利用度等效才能獲批上市,科學看待參比製劑質量,正確評估參比製劑品質,對仿製製劑的研發有重要的指導意義,尤其是麵對目前仿製藥醫改時限的緊迫壓力,更要求企業在參比製劑選擇上要謹慎。針對仿製藥如何確立合適的參比製劑的研究,hjc黄金城製劑部副總裁李國棟博士在今年3月底hjc黄金城與廣東省藥學會製藥工程專委會等聯合舉辦的“仿製與創新”主題會議上做過詳細的介紹(會議報道鏈接:
李國棟教授當時在會議上係統介紹了仿製藥一致性評價的關鍵技術點,針對參比製劑的研究,李教授表示企業可以根據參比製劑選擇和確定原則來確定參比製劑,一定要全麵查詢參比製劑相關的FDA申報資料、EMA 的assessment report、PMDA的IF文件、日本橙皮書溶出曲線和BE數據、阿根廷藥監部門公開信息等,並且強調,參比製劑的處方工藝信息有可能會出現在原研公司其他產品的專利上,需要重點關注等問題。最後還以鹽酸普羅帕酮緩釋膠囊為例予以說明,PPT詳情如下:



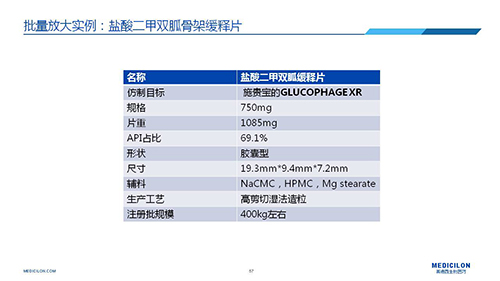
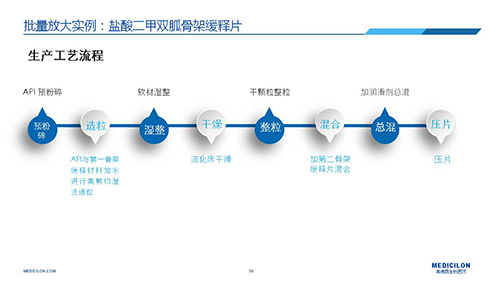
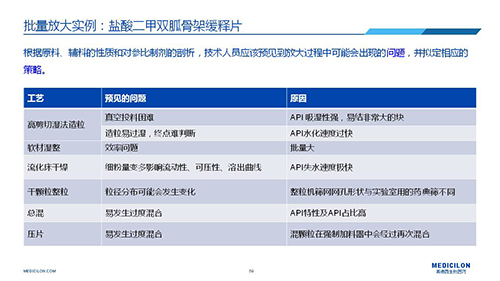
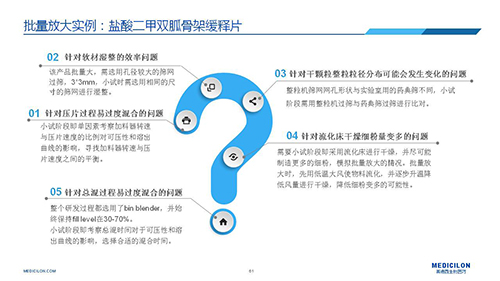
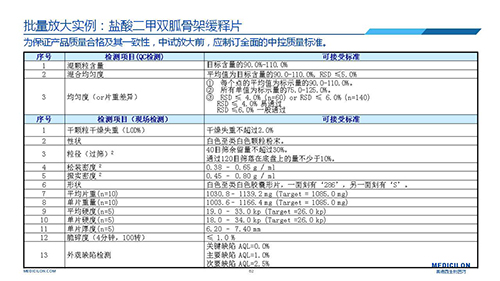
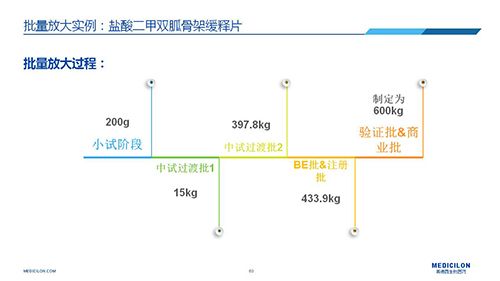
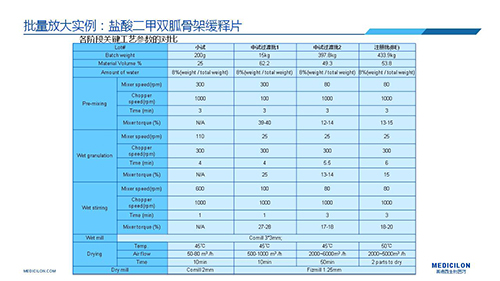
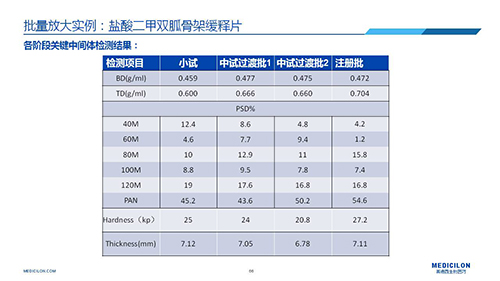
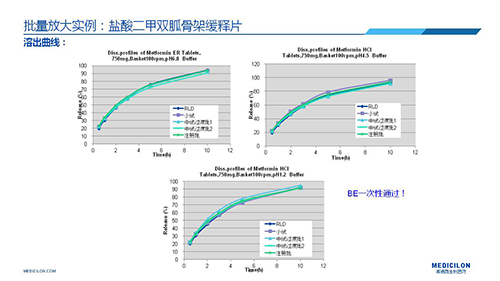
三 BE試驗一次性通過的案例——“鹽酸二甲雙胍骨架緩釋片”
選擇合適的參比製劑是仿製藥研發成功的第一步,仿製藥一致性評價研發的關鍵目標是要穩健的處方工藝,放大到工業生產批次BE達到一致才算完成。據統計,目前估計僅100家藥物臨床機構可承接BE項目,而且市場價格高昂,因此BE一旦失敗企業將損失慘重。考慮BE失敗影響因素很多,仿製藥企業隻重視參比製劑環節還遠遠不夠。因此會議上李教授分享了一個BE試驗一次性通過的案例——“鹽酸二甲雙胍骨架緩釋片”給仿製藥同行們參考,希望能有所幫助,PPT詳情如下: