
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




小核酸抗體偶聯藥物(Antibody-oligonucleotide conjugates,AOC)利用抗體將治療性寡核苷酸遞送至特定細胞或組織,將抗體的組織特異性優勢,與小核酸的靶點特異性優勢相結合,可一定程度上用於解決目前小核酸藥物僅能通過脂質納米顆粒(LNP)、N-乙酰半乳糖胺(GalNAc)遞送係統靶向肝髒的問題。
往期文章中,我們通過"偶聯藥物解讀(五)| 新模式——小核酸抗體偶聯藥物(AOC)"(點擊了解),詳細介紹了小核酸藥物遞送技術發展曆程,AOC藥物偶聯技術原理,及AOC優勢等。本篇文章主要從全球AOC市場布局出發,分析AOC在研公司現狀及未來發展趨勢和關注點,希望對關注核酸藥物和偶聯藥物領域的各位研究者有所幫助。
小核酸藥物在當前醫藥行業中非常火熱,但在遞送技術的創新層麵依然存在困境,已上市的小核酸藥物僅能針對肝髒靶點。目前,小核酸的非肝靶向遞送在國外已引起諸多公司的關注,Avidity Biosciences的AOC於2021年11月首次進入臨床研究,至今已在超過30例病人身上完成給藥。Dyne Therapeutics的AOC藥物也於2022年9月啟動臨床病人入組。AOC結合了小核酸的靶點特異性和抗體等大分子藥物的組織特異性兩大優點。
目前全球在研AOC的公司主要有:Avidity Biosciences、Dyne Therapeutics、Tallac Therapeutics、Denali Therapeutics等。
公司總部位於美國加州,通過抗體寡核苷酸偶聯物(AOCs TM )平台,將單克隆抗體的特異性與寡核苷酸療法的精度結合起來,能夠遞送給以前無法達到的組織和細胞類型,以靶向以前RNA療法無法治療的疾病,並更有效地針對疾病的潛在遺傳驅動因素。Avidity公司的AOC平台能夠偶聯各種類型的寡核苷酸,包括siRNA和磷酰二胺嗎啉代寡核苷酸(phosphorodiamidate morpholino oligomer, PMO),這種靈活性能夠使得該公司根據不同的疾病類型設計不同的AOC藥物。與傳統寡核苷酸療法相比,AOC具有更好的藥代動力學特性和更具特異性的生物分布,而且可以避免使用脂質體遞送寡核苷酸帶來的毒副作用。
AOC 1001通過Avidity Biosciences 的AOC平台所生產,由一款靶向1型轉鐵蛋白受體(TfR1)的單克隆抗體和一種靶向DMPK mRNA的siRNA偶聯而成,旨在降低強直性肌營養不良症1型(Myotonic dystrophy type 1, DM1)患者成纖維細胞中異常DMPK mRNA水平,從根本上解決DM1。臨床前研究數據顯示,AOC 1001能夠成功將siRNA遞送到肌肉細胞中,導致DMPK mRNA在多種肌肉(包括骨骼肌、心肌和平滑肌)產生持久的劑量依賴性降低。
AOC1020是一種靶向DUX4的siRNA抗體偶聯物。DUX4(Double Homeobox 4)屬於雙同源盒轉錄因子。同源盒基因在進化上是高度保守的,對於發育的調控至關重要。AOC1020通過降低DUX4的表達來達到治療麵肩肱型肌營養不良症(Facioscapulohumeral muscular dystrophy, FSHD)的目的。目前已經處於1/2期臨床試驗階段,該藥是基於公司的RNA平台技術設計的首款AOC藥物,適應症為杜氏肌肉營養不良症(Duchenne Muscular Dystrophy, DMD)。DMD是一種肌營養不良蛋白缺乏引起的X染色體隱性遺傳神經肌肉病。目前DMD尚無有效治愈手段,基因替代、外顯子跳躍、基因組編輯、終止密碼子通讀等基因治療逐步成為研究熱點。

Avidity Biosciences 管線(來自官網)
總部位於美國馬薩諸塞州,是一家針對嚴重肌肉疾病開發靶向治療的生物製藥公司。公司主要聚焦三大罕見肌肉疾病,包括DM1、DMD和FSHD。憑借其專有的 FORCE™ 平台,Dyne 正在開發新型寡核苷酸療法。FORCE™ 平台以 TFR-1 受體為靶點(TFR-1 受體在肌肉細胞表麵高度表達),通過將抗體與治療嚴重肌肉疾病的寡核苷酸連接來設計治療分子。
DYNE-251是針對攜帶51號外顯子跳躍突變的DMD患者開發的抗體偶聯寡核苷酸藥物,其由PMO與Fab片段結合組成。DYNE-251可以靶向結合目標肌肉組織中高度表達的轉鐵蛋白受體1(TfR1),通過促進外顯子的跳躍,使肌肉細胞產生短且具有功能的肌肉營養不良蛋白,從而阻止或逆轉疾病的進程。
DYNE-101用於治療DMD的I/II期臨床試驗正在進行中。DYNE-101由與反義寡核苷酸(ASO)結合的抗原結合片段抗體(Fab)組成,以實現肌肉組織的靶向遞送,目的是減少細胞核中有毒的DMPK RNA,釋放剪接蛋白,允許正常mRNA處理和正常蛋白的翻譯,並有可能阻止或逆轉疾病。
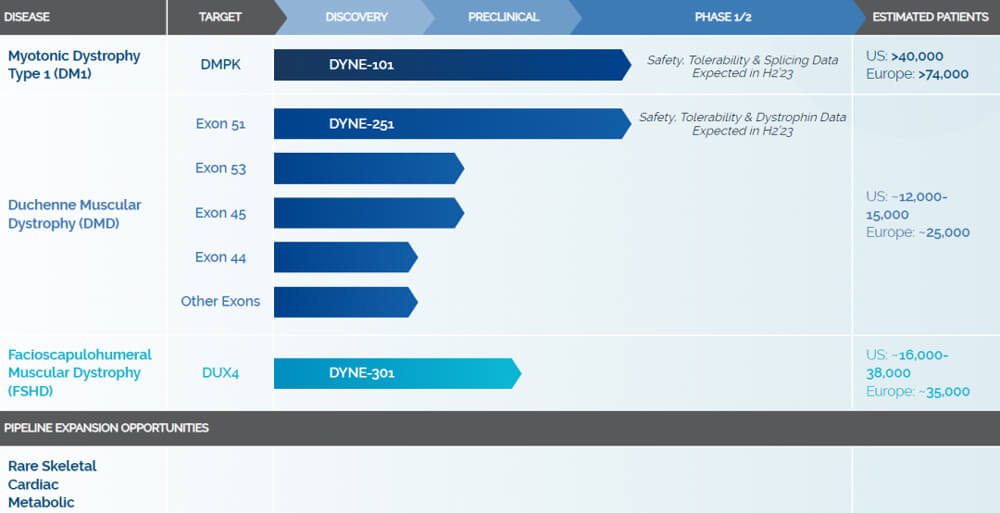
Dyne Therapeutics管線(來自官網)
總部位於美國加州,致力於開發一種使用抗體-免疫激活劑偶聯物進行靶向免疫激活的技術,利用先天性和適應性免疫力開發抗癌療法, 產品線基於其新穎的Toll樣受體(TLR)激動劑抗體偶聯藥物(TRAAC)平台。
TAC-001是一種全身遞送的藥物,是一種由強效的T-CpG與CD22抗體結合的AOC,通過與CD22結合將T-CpG遞送給B細胞,進而導致TAC-001的內化以及TLR9信號、B細胞激活,產生一係列免疫反應。TAC-001引發的先天性和適應性免疫反應在檢查點抑製劑耐藥和難治性腫瘤模型中顯示出強大、治愈和持久的單藥抗腫瘤活性。
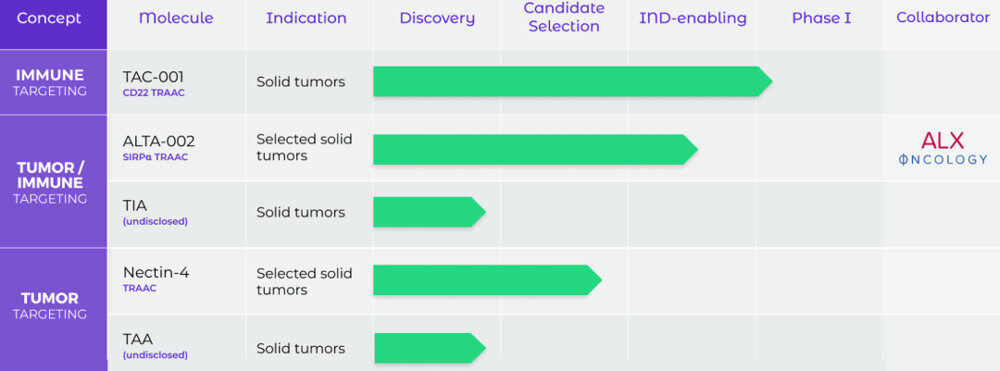
Tallac Therapeutics管線(來自官網)
小核酸藥物與小分子化藥和抗體藥相比較具有顯著優勢,將成為今後主流藥物。小核酸藥物可覆蓋更多靶點和可應用更多的臨床適應症,具有更大的市場空間。穩定性修飾以及高效遞送係統的開發很好的解決了siRNA靶向遞送問題,治療領域從以往的罕見病到一些常見病,應用範圍逐漸擴大。
但小核酸藥物整體研發仍處於早期階段,尤其是技術平台和專利平台需加快建設。小核酸藥物技術難點仍有待多層突破,尤其是靶向遞送和有效作用需加快研發。仍需要開展大量研究來確定抗體與小核酸的最佳結合方式,並篩選受體靶點,以識別對所需組織和細胞類型具有特異性的受體,從而提供最佳療效,同時避免細胞毒性作用。在高效的肝靶向以外,小核酸藥物邁向更廣泛的組織類型中仍有待於遞送工具的拓展。
AOC作為一種簡便、特異性高、不良反應小的組合式創新遞送手段,提供了更多的可能性;我們期待AOC作為一種新型偶聯藥物在多種疾病的治療領域取得更多的突破。
[1] Kalina Paunovska, et al. Drug delivery systems for RNA therapeutics. Nat Rev Genet. 2022 May;23(5):265-280. doi: 10.1038/s41576-021-00439-4.
[2]. Julien Dugal-Tessier, et al. Antibody-Oligonucleotide Conjugates: A Twist to Antibody-Drug Conjugates. J Clin Med. 2021 Feb 18;10(4):838. doi: 10.3390/jcm10040838.
[3]. Victor Lehot, et al. Non-specific interactions of antibody-oligonucleotide conjugates with living cells. Sci Rep. 2021 Mar 15;11(1):5881. doi: 10.1038/s41598-021-85352-w.
[4]. K Sreedurgalakshmi, et al. Cetuximab-siRNA Conjugate Linked Through Cationized Gelatin Knocks Down KRAS G12C Mutation in NSCLC Sensitizing the Cells Toward Gefitinib. Technol Cancer Res Treat. 2021 Jan-Dec;20:15330338211041453. doi: 10.1177/15330338211041453.
[5]. Nicole Bäumer, et al. Antibody-coupled siRNA as an efficient method for in vivo mRNA knockdown. Nat Protoc. 2016 Jan;11(1):22-36. doi: 10.1038/nprot.2015.137.
[6]. Hua Lu, et al. Site-specific antibody-polymer conjugates for siRNA delivery. J Am Chem Soc. 2013 Sep 18;135(37):13885-91. doi: 10.1021/ja4059525.
[7]. Patrick J Kennedy, et al. Antibodies and associates: Partners in targeted drug delivery. Pharmacol Ther. 2017 Sep;177:129-145. doi: 10.1016/j.pharmthera.2017.03.004.
[8]. Guizhi Zhu, et al. Aptamer-Drug Conjugates. Bioconjug Chem. 2015 Nov 18;26(11):2186-97. doi: 10.1021/acs.bioconjchem.5b00291.
[9]. Tsukasa Sugo, et al. Development of antibody-siRNA conjugate targeted to cardiac and skeletal muscles. J Control Release. 2016 Sep 10;237:1-13. doi: 10.1016/j.jconrel.2016.06.036.
[10]. Asher Mullard. Antibody-oligonucleotide conjugates enter the clinic. Nat Rev Drug Discov. 2022 Jan;21(1):6-8. doi: 10.1038/d41573-021-00213-5.