目前在臨床試驗中有42種針對COVID-19的疫苗,這些疫苗的類型各不相同,其中包括DNA質粒疫苗、滅活病毒疫苗、腺病毒載體疫苗、RNA疫苗、蛋白質亞單位疫苗和病毒樣顆粒疫苗。在早期臨床試驗中,其中一些已被證明是安全的並能引發免疫反應。目前迫切需要一種針對SARS-CoV-2的疫苗,以防止COVID-19的進一步波動。用BBIBP-CorV免疫可快速誘導針對SARS-CoV-2的免疫反應,這對於預防或限製COVID-19大流行具有重要意義,有必要進行進一步的臨床研究,以評估這種疫苗在臨床應用中的潛力。
近日,柳葉刀上發表了一篇關於由中國研發的一種新型滅活候選疫苗BBIBP-CorV的安全性和免疫原性的臨床試驗,研究中使用的BBIBP-CorV疫苗是從一名中國患者身上分離出的病毒樣本。該病毒的原種在實驗室中使用細胞係進行生長,然後使用一種稱為β-丙酸內酯的化學物質進行滅活。
先前的一項臨床試驗報道了另一種同樣基於滅活完整SARS-CoV-2病毒的疫苗的相似結果,但是在該研究中,該疫苗僅在60歲以下的人群中進行了測試。本次研究的作者之一,中國北京生物製品有限公司的楊曉明教授說:“保護老年人是COVID-19疫苗的主要目標,因為這這種疫苗可能會導致嚴重疾病的風險,由於免疫係統隨著年齡的增長而減弱,因此該組疫苗有時效果較差,但令人鼓舞的是,BBIBP-CorV可以誘導60歲以上的人產生抗體反應,因此我們相信有理由進一步調查。”
最新研究包括年齡在18至80歲之間的參與者,並發現在所有接受者中均誘發了抗體反應。60歲及以上的參與者反應較慢,在所有接受者中均檢測到抗體需要42天,而18-59歲的參與者則需要28天,這是對人類參與者進行測試的滅活SARS-CoV-2疫苗的首次報導。該試驗表明,滅活的SARS-CoV-2疫苗BBIBP-CorV在健康人群中是安全、可耐受和具有免疫原性的。

01 方法
在第1階段的2020年4月29日至6月28日之間,篩選了466位參與者,並入組192位(男性47%,女性53%;50%年齡18-59歲,50%≥60歲;平均年齡53歲)。18至59歲的小組中有96名參與者,60歲及以上的小組中有96名參與者。在這些組中,隨機分配了32名參與者,分別以3:1的比例接受2劑2μg、4μg或8μg疫苗或安慰劑。因此,有144名參與者接受了疫苗,48名參與者接受了安慰劑。分析中包括了他們的安全性數據和現有的免疫原性數據,所有入選患者均無基礎疾病。
在第二階段,即2020年5月18日至7月30日,篩選了546位18-59歲的參與者,並招募了448位參與者(男性45%,女性55%;平均年齡42歲)。所有入選患者均無基礎疾病。為了測試8μg抗原在不同組合中的影響,通過單次全劑量或兩次劑量的每種均含4μg抗原,將參與者隨機分配為在第0天(n = 112)接種8μg疫苗或安慰劑,或在第0和14天(n = 112)、0和21天(n = 112)或0和28天(n = 112)接種4μg疫苗或安慰劑。
02 不良事件
最常見的注射部位不良反應是疼痛,第1階段的144名疫苗接種者中,有34名(24%)報告疼痛,而48名安慰劑接受者中有3名(6%)。對於18-59歲年齡組(n = 72)的疫苗接種者,除了疼痛另外的注射部位不良反應包括腫脹。對於60歲及以上年齡組(n = 72)的疫苗接種者,除了疼痛另外的注射部位不良反應是硬結。研究人員觀察到,在18-59歲年齡組中,與安慰劑組相比有統計學上更高的疼痛報告。
在第2階段的336種疫苗接種者中,有76名(23%)接種了疫苗後的前7天內至少發生了一種不良反應。疫苗接種者組中最常見的注射部位不良反應是疼痛(336例中的53例[16%]),高於安慰劑組(112例中的4例[4%];p = 0·008)。疫苗接種者組中最常見的係統性不良反應是發燒(336例中的7例[2%])。4μg第0和21天組的一名安慰劑接受者報告3級發燒,但自我康複,所有其他不良反應的嚴重程度為輕度或中度。
03 結果
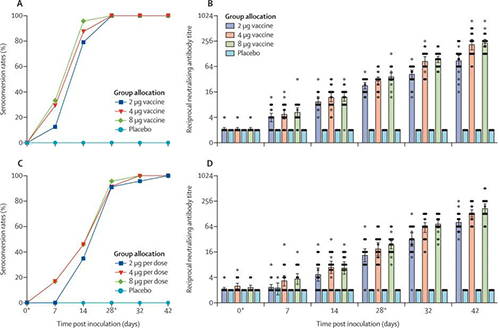
60歲及以上的血清轉化率和中和抗體滴度(來源:The Lancet)
在第1階段對於18-59歲組中的疫苗接種者,2μg組中的24人中有19人(79%),4μg組中的24人中有21人(87%),8μg組中的24人中有23人(96%)在第14天進行血清轉換。在第28天,所有三個隊列的血清轉化率均達到100%。對於60歲及以上年齡組的疫苗接種者,在2μg組中的23人中有8人(4%),在4μg組中的24人中有11人(46%)在第14天對血清進行了血清學轉換。其中2μg組中的23人中有21人(91%),4μg組中的24人中有22人(92%)和8μg組中的23人中有22人(96%)在第28天之前進行了血清轉換,所有安慰劑接受者的中和抗體在整個試驗中均為陰性。
第一次接種後第7天,在143名疫苗接種者中有26名(18%)檢測到抗傳染性SARS-CoV-2的中和抗體,第二次接種後第42天,檢測到中和性抗體上升到100%。在18-59歲年齡組中,到第28天三個疫苗接受者隊列中的中和抗體GMT大於安慰劑隊列。到第28天,2μg隊列中的中和抗體GMT顯著低於8μg隊列(p = 0·0093),4μg隊列中的中和抗體GMT與8μg隊列中的無顯著差異(p = 0·58)。到第42天,在2μg隊列中的中和抗體GMT明顯低於8μg隊列,在4μg隊列中的中和抗體GMT在統計學上與8μg隊列(p> 0·99)相當。
在60歲及以上的年齡組中,到第28天疫苗接種者的中和抗體GMT更高。到第28天,在2μg(p = 0·087)和4μg(p = 0·96)隊列中的中和抗體GMT與8μg隊列中的抗體無顯著差異。到第42天,2μg隊列中的中和抗體GMT顯著低於8μg隊列,在4μg隊列中的中和抗體GMT與8μg隊列(p = 0·30)沒有顯著差異。
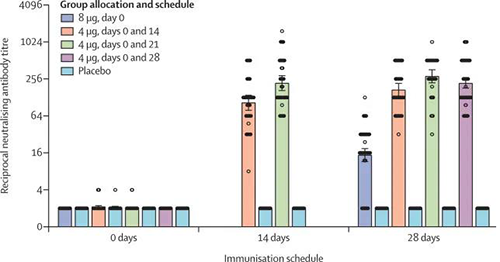
不同免疫方案的中和抗體滴度(來源:The Lancet)
免疫前為0天、14天和28天是指第二次接種後的第14天和第28天,除了8μg第0天組(其中是指單次接種後的第28天)。對於4μg的第0天和第14天以及第0天和第21天組,從該組一半的參與者中收集第14天的樣品,從另一半中收集第28天的樣品。在第2階段,在所有四個疫苗接種計劃中,中和抗體GMT大於安慰劑隊列。到第二次接種後的第0天、第4天和第14天隊列中的中和抗體顯著低於第0天、第4天和第21天隊列中的中和抗體。在最後一次接種後第0天、第8天第28天隊列的中和抗體GMT顯著低於第0天和14天、0和21天以及0和28天隊列的中和抗體(所有p < 0·001)。
04 討論
在1/2期試驗中,BBIBP-CorV滅活疫苗以兩劑免疫方式接種,在兩個年齡段的所有三個劑量下均安全且耐受性良好。在100%的疫苗接種者中觀察到了強大的體液免疫反應。在臨床前研究中,研究人員表明用BBIBP-CorV免疫可在小鼠、大鼠、豚鼠、兔和非人類靈長類動物中誘導高水平的中和抗體滴度。本次試驗中最常見的不良反應是疼痛和發燒,所有不良事件的嚴重程度均為輕度或中度。值得注意的是,安慰劑組的全身不良反應數量更高,但是在對呼吸道症狀的隨訪監測中,未檢測到上呼吸道感染。在實驗室測量中也沒有臨床上明顯的異常變化,也沒有任何與疫苗有關的變化。
BBIBP-CorV具有免疫原性,可快速誘導強大的體液反應。對於60歲及以上的患者以及先前患有呼吸道疾病或心血管疾病的患者,COVID-19表現出嚴重疾病和死亡的極高風險。在該試驗中,研究人員旨在評估BBIBP-CorV在60歲及60歲以上患者中的安全性和耐受性。18至59歲年齡組的血清轉化率比60歲以上年齡組的血清轉化率更早。第一次接種疫苗後(第14天),年齡在18-59歲的人群中有超過75%的患者進行血清轉化,其餘的疫苗接種者在第28天進行血清轉化。對於60歲及以上的年齡組,4μg和8μg劑量接受者的血清轉化率在第28天達到100%,而2μg組在第42天進行血清轉化,60歲及以上年齡組的中和抗體強度低於18-59歲年齡組。BBIBP-CorV誘導的中和抗體可以中和多個SARS-CoV-2菌株,這些發現表明,BBIBP-CorV具有針對其他SARS-CoV-2菌株提供交叉保護的潛力。
該研究結果的解釋受到隨訪時間短的限製,另一個局限性是缺乏對兒童和青少年的安全性和免疫原性測試。盡管這是該試驗原始計劃的一部分,但在完成對成人組的全麵分析之前,研究人員表示不會開始對18歲以下的人群進行測試。總之,研究人員發現滅活SARS-CoV-2的疫苗BBIBP-CorV在健康人群中具有耐受性和免疫原性。首次接種後第4天開始觀察到針對SARS-CoV-2的快速體液反應,第42天在所有參與者中發現100%血清轉化。第0天和第21天以及第0天和第28天的兩次免疫方案引發了更大的中和抗體。接下來仍然會進一步研究這種滅活疫苗以控製和預防COVID-19,與此同時正在進行的1/2期和3期試驗將提供有關BBIBP-CorV的安全性、免疫原性、劑量和免疫計劃的更多信息。
關於hjc黄金城
hjc黄金城(股票代碼:688202)成立於2004年,總部位於上海,致力於為全球製藥企業、研究機構及科研工作者提供全方位的臨床前新藥研究服務。hjc黄金城的一站式綜合服務以強有力的項目管理和更高效、高性價比的研發服務助力客戶加速新藥研發進程,服務涵蓋醫藥臨床前新藥研究的全過程,包括藥物發現、藥學研究及臨床前研究。hjc黄金城與國內外優質客戶共同成長,為全球超過700家客戶提供新藥研發服務,hjc黄金城將繼續立足全球視野,聚力中國創新,為人類健康貢獻力量!
聯係我們
Email:
marketing@yakkaa.com
電話: +86 (21) 5859-1500(總機)















 相關新聞
相關新聞