2017年1類新藥審批加速度!85個獲批臨床,1個獲批生產
摘要
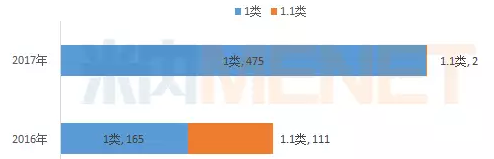
2017年CDE共承辦1類新藥申請475個,涉及215個通用名
抗腫瘤藥為新藥申報的熱門領域,EGFR和PD-L1為熱門靶點
恒瑞醫藥有13個新藥首次進入CDE
截至目前已有85個產品獲批臨床,1個產品獲批生產
2017年5月11-12日,兩天之內,國家食品藥品監督管理總局(CFDA)連發四文,公開征求意見,劍指醫藥創新和審批提速。鼓勵創新政策頻出,為醫藥行業營造良好的新藥研發環境,整個醫藥界全年幾乎都沉浸在一種興奮的情緒中。國內創新藥環境正不斷改善,醫藥產業迎來了新的發展機遇。2017年,新申報的1類新藥數量同比去年大幅度提升,隨著各種政策的持續推進,2018年我國創新藥研發勢將繼續煥發新活力。
新藥承辦情況
2017年是化學藥品注冊分類改革工作方案全麵鋪開的第一年,據米內網MED中國藥品審評數據庫2.0統計,截至2017年12月,CDE承辦1類新藥215個(按通用名計),涉及475個受理號,其中有200個產品為CDE首次承辦。
圖1:2016年和2017年CDE1類新藥承辦情況
從治療領域來看,在已經明確治療領域的1類新藥中,抗腫瘤藥仍是目前的申報熱點領域,而在抗腫瘤藥中,EGFR抑製劑和PD-L1單抗申報數量較多,成為2017年的熱門靶點。
圖2:2017年1類新藥在各治療領域占比情況(按藥品通用名數量統計)
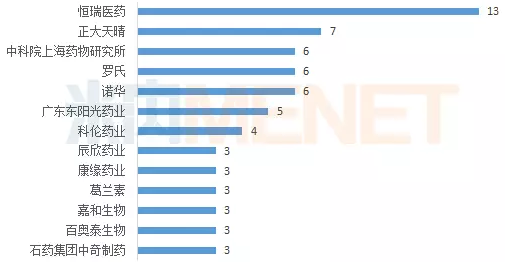
從企業角度看,新藥數量超過3個的企業有13家,其中國內企業有10家。雖然新藥研發需要投入大量資金,但近幾年新藥研發的利好政策頻出,這讓國內不少企業紛紛注重創新研發。
恒瑞醫藥獨占鼇頭,顯示出強大的研發能力,有13個新藥首次進入CDE。正大天晴也有7個新藥進入CDE。中科院上海藥物研究所、羅氏以及諾華均有6個。
圖3:2017年CDE承辦的1類新藥企業情況
2017年CDE承辦的1類新藥中,有9個產品被納入優先審評。從申報類型看,葛蘭素史克的Cabotegravir,南京傳奇生物的CAR-T療法藥物以及羅氏的RO7034067為臨床申請,其它均為上市申請。
表1:2017年1類新藥納入優先審評情況
新藥審批情況
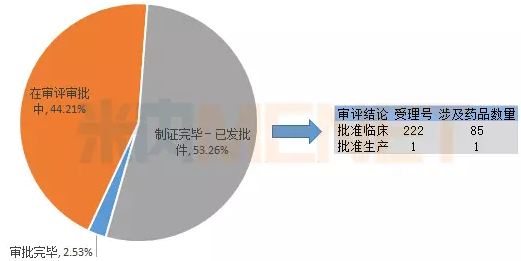
據米內網MED中國藥品審評數據庫2.0顯示,CDE在2017年所承辦的1類申請中,已有超過50%的受理號完成審批,在辦理狀態為“已發批件”的申請中,有222個受理號獲批臨床,涉及85個藥品,而獲批生產的受理號則隻有1個,涉及1個藥品。
圖4:2017年CDE承辦1類新藥的審批情況
(數據統計截至2018年2月1日,下同)
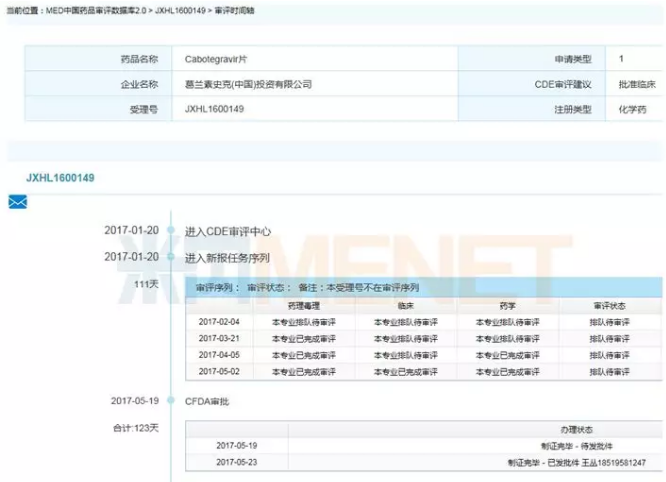
據米內網MED中國藥品審評數據庫2.0審評時間軸顯示,在特殊審評品種和納入優先審評的加持下,葛蘭素史克的Cabotegravir在2017年1月進入CDE後僅用了123天(約四個月)便完成審評審批,並獲批臨床。Cabotegravir是一種長效HIV整合酶抑製劑, 用於治療和預防艾滋病毒感染。葛蘭素史克提交了該藥的片劑和混懸注射劑液等兩個劑型的臨床申請。
圖5:Cabotegravir相關查詢信息
圖6:Cabotegravir片的審評審批時間軸
以下是目前米內網MED中國藥品審評數據庫2.0統計的2017年CDE承辦的1類新藥審批情況:
表2:2017年CDE承辦1類新藥審批情況
注:藥品治療領域、適應症信息為作者根據現有資料查詢整理所得,如有錯漏,歡迎補充指正。

分享到:


















 相關新聞
相關新聞