一致性評價落地在即:非289目錄30產品可望火線獲LOGO
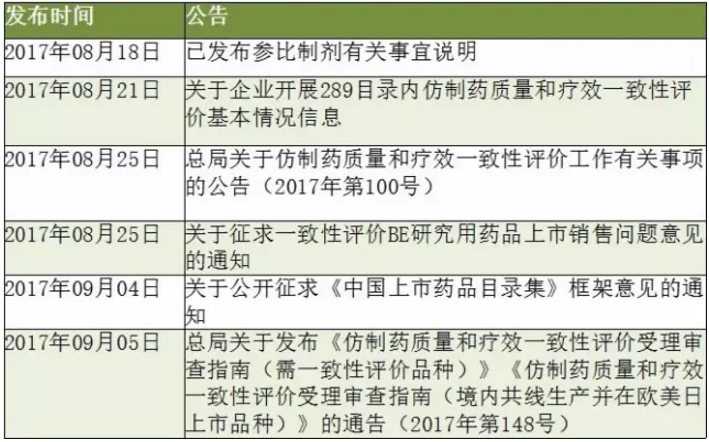
2017年8月起,CFDA/CDE針對一致性評價連續發了幾大公告(如表1所示),公告內容包括對目前289目錄內仿製藥進展情況和“通過一致性評價”標識圖的公布,中國仿製藥橙皮書(《中國上市藥品目錄集》)的雛形也發布了征求意見稿,這意味著一致性評價開始進入政策執行期。
表1:CFDA/CDE近期發布的政策一覽
(數據來源:鹹達數據V3.2)
289目錄品種:參比製劑尚未完全準備好
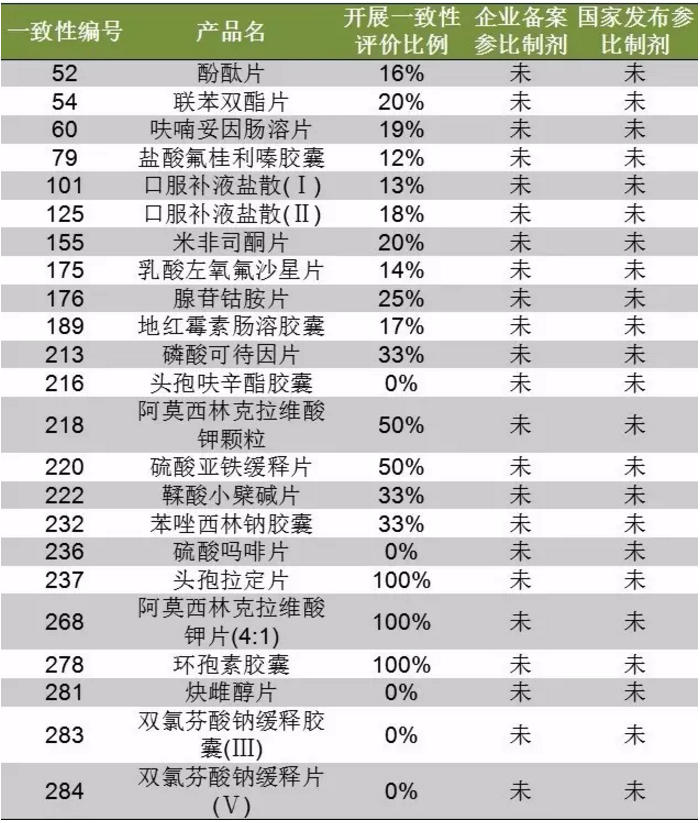
根據《總局關於仿製藥質量和療效一致性評價工作有關事項的公告》,為便於企業選擇參比製劑,CFDA總局將把《關於落實〈國務院辦公廳關於開展仿製藥質量和療效一致性評價的意見〉有關事項的公告》(2016年第106號)所附289個品種的原研企業藥品列出清單並向社會公布,供企業選擇參比製劑時參考。鹹達數據V3.2整理截至2017年9月6日CFDA所公布的八批參比製劑後發現,289目錄產品中仍有112個暫未公布參比製劑。
另外,CFDA承諾,企業報總局備案的參比製劑全部向社會公開。相較之下,企業申報參比製劑還是相對積極。2017年9月4日中國食品藥品檢定研究院所公布的企業參比製劑備案情況(2016年5月20日至2017年8月20日)數據展示,289目錄產品中46個暫未有企業申報參比製劑備案。
企業和國家都未公布參比製劑的產品有23個。然而與CFDA所公布的企業開展289目錄內仿製藥質量和療效一致性評價的基本情況比較發現,隻有5個產品沒有開展一致性評價,其餘產品都有企業正在開展。這意味著企業備案參比製劑與實際開展一致性評價的情況還是有信息差。
表2:企業和國家都未有參比製劑的名單
(數據來源:鹹達數據V3.2)
289以外品種:30個藥品獲“一致性”標識在望
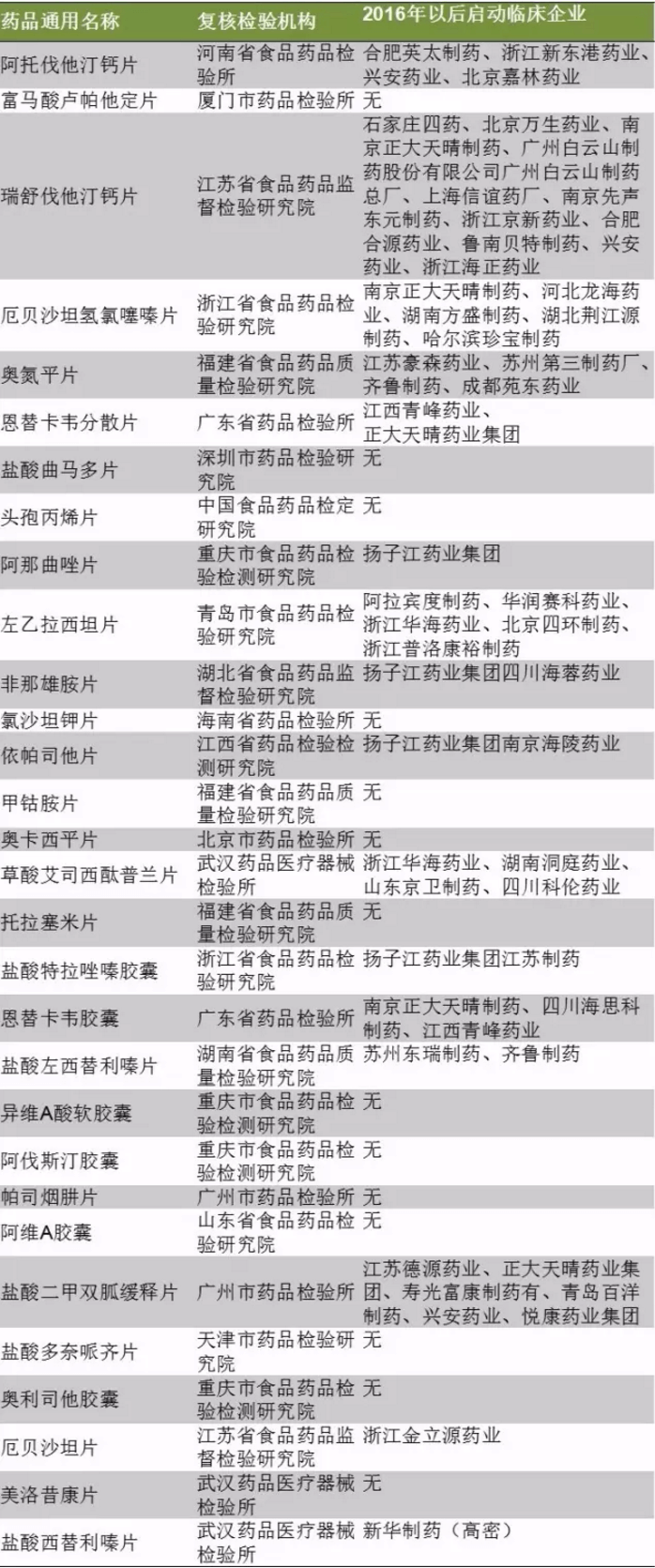
自2017年6月起,仿製藥質量與療效一致性評價辦公室公布了兩批289目錄以外品種複核檢驗機構名單,共30個產品涵括在其中。
筆者認為,這30個產品應有企業申報了一致性評價,仿製藥質量與療效一致性評價辦公室才會公布複核檢驗機構。
如表3所示,富馬酸盧帕他定片、鹽酸曲馬多片、頭孢丙烯片、氯沙坦鉀片、甲鈷胺片、奧卡西平片、托拉塞米片、異維A酸軟膠囊、阿伐斯汀膠囊、帕司煙肼片、阿維A膠囊、鹽酸多奈呱齊片、奧利司他膠囊和美洛昔康片2017年以後暫未申報臨床。
其中,石藥集團的鹽酸曲馬多片和鹽酸多奈呱齊片、華海藥業氯沙坦鉀片、華潤雙鶴的美洛昔康片都獲得美國ANDA,除了石藥鹽酸多奈呱齊片外都是國內已上市的產品。預計14個2016年以後未啟動臨床但又進入複核名單的部分產品申報一致性的,是境內共線生產並在歐美日上市的品種。
2016年以後啟動臨床的16個產品中,揚子江藥業集團有限公司獨家啟動臨床的產品數最多,共3個,分別是阿那曲唑片、非那雄胺片和依帕司他片。產品方麵,瑞舒伐他汀鈣片臨床啟動的熱度最高。
表3:具複核檢驗機構289目錄以外品種的2016年至今臨床申報情況
(數據來源:鹹達數據V3.2)
思考<<<
目前一致性評價主要政策利好為:藥品集中采購即醫療機構采購時,生產廠家享有價格優待的權利。但是,目前仿製藥質量與療效一致性評價辦公室暫未公布獲得通過一致性評價的品種清單。這也意味著,“同品種藥品通過一致性評價的生產企業達到3家以上的,在藥品集中采購等方麵不再選用未通過一致性評價的品種”及“通過一致性評價的藥品品種,社會保障部門將在醫保支付方麵予以適當支持,醫療機構應優先采購並在臨床中優先選用”的政策實際未執行。
值得注意的是,由於醫療機構“零加成”方麵的改革,醫院開始托管藥房,口服藥的市場逐步從醫療機構往院外藥房轉移。但是,藥房是不受藥品集中采購的政策所約束的,這意味著藥房還是可以銷售未通過一致性評價的品種。因此,從目前看來,通過一致性評價的品種的政策利好有限,隻能寄望於醫保支付背景下醫療機構的使用量。

分享到:
















 相關新聞
相關新聞