
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




最近,【自然癌症進展】上發表評論文章,稱巨噬細胞“竊用”了免疫療法的大秀台 [1]。這個說法主要是基於最近的兩篇報道發現巨噬細胞跟PD-1的聯係比我們以前以為的要更加密切。首先是Pittet等人報道巨噬細胞會識別並“扣留“、吞噬作為治療用的PD-1抗體,從而降低其療效[2]。而Weissman等人則報道從腸癌等樣品中分離的巨噬細胞,其中很大的部分表麵含有PD-1抗原,這些被腫瘤“馴服”的M2類型的巨噬細胞吞噬腫瘤細胞的能力由此大大降低[3]。
與“專業選手”T細胞相比,巨噬細胞這個“業餘選手”也能搭建自己的抗腫瘤舞台嗎?
早在1970年代,就有報道提到細胞或細胞因子激活的巨噬細胞具有抗腫瘤活性[4]。但在同時,卻也有報道發現腫瘤相關的巨噬細胞(TAM)能夠促進癌細胞的生長和轉移[5]。這與巨噬細胞本身的正常生理功能其實是吻合的。巨噬細胞根據功能和極性分類,可籠統分為M1和M2兩大類型(最新報道,細分起來,有超過20幾類還多)。M1主要參與炎症反應,識別、吞噬外來入侵物(包括變異腫瘤細胞)及清除體內細胞碎片。M2主要參與免疫抑製及愈傷組織修複 [6]。
體現在對腫瘤關係上,巨噬細胞就是有時殺傷腫瘤,經常輔助腫瘤生長轉移,總是騎牆派。
或者說巨噬細胞“匪性”很強,農忙時回家種地促生產,農閑時打家劫舍搞破壞,具有陰陽雙性。

巨噬細胞的極性取決於疾病發生的階段,所涉及的組織,甚至宿主微生物的狀態。個人感覺,早期的腫瘤微環境,至少部分巨噬細胞可能更傾向於積極的抗腫瘤免疫反應,晚期的腫瘤,巨噬細胞被多被腫瘤細胞欺騙,誘惑,收編,更多的傾向於支持腫瘤細胞生長,轉移,並抑製積極的免疫反應。
絕大多數情況下,腫瘤相關巨噬細胞都是“從犯”,“協犯”,不是主要致癌因素,所以更多時候靶向TAM是幫助、教育它轉性,從M2類型轉化成M1類型,讓巨噬細胞從助癌變成抑癌,而不是殺死巨噬細胞。當然,個例也是存在的,下麵會有討論。
靶向巨噬細胞的潛在靶點較多,臨床上進展較快的主要靶點有:CSF-1R、CD47、CD40、巨噬細胞微環境趨化因子等。

迄今為止,還沒有直接靶向巨噬細胞的藥物獲得FDA批準。
CSF-1R是迄今靶向巨噬細胞研究最成熟的靶點之一。CSF-1R屬於絡氨酸受體激酶,僅在單核細胞係,如巨噬細胞表麵表達,其主要配體之一CSF-1與之結合後可以促進巨噬細胞的生長、分化。在多種腫瘤,如乳腺癌、肝細胞癌等中發現,高CSF-1或CSF-1R表達水平與不良生存預後呈正相關。
靶向CSF-1R的策略既可以用大分子抗體靶向其CSF-1配體,或CSF-1R受體,也可以設計小分子靶向激酶活性區域。
目前臨床上活躍的藥物包括5個抗體、4個小分子。較為領先的抗體是Roche的Emactuzumab(RG7155),小分子是Plexxikon 的PLX-3397 [7]。

CSF-1/CSF-1R信號通路大部分情況下不是致癌驅動因素。但在一類罕見的腱鞘巨細胞瘤(TCGT,tenosynovialgiant-celltumor),CSF-1卻是元凶。這類細胞瘤主要發生在關節部位,特別是膝關節。發病人群較為年輕,平均年齡為35歲左右。目前主要治療手段是手術,但複發率比較高,患者急需新的療法。TCGT致病機理主要是少量位於滑膜襯裏的細胞由於CSF-1的染色體移位,造成其持續過量表達,從而吸引、招募過多的巨噬細胞造成的組織增生。早前,這類疾病還劃歸於自身免疫疾病,叫色素沉著絨毛結節性滑膜炎(PVNS,pigmentedvillonodularsynovitis),也是有道理的。臨床上,這類細胞瘤是驗證CSF-1/CSF-1R靶向藥物有效性的理想對象[7]。
最早Imatinib就對這個疾病進行了嚐試。但由於imatinib的CSF-1R的活性較弱,總體應答率較低,隻有19%。
Roche的CSF-1R的抗體emactuzumab具有極高的活性。臨床前的試驗表明其能夠有效地抑製M2類型的巨噬細胞,促進T細胞活性的增加[8]。在TCGT的臨床試驗中也表現出積極的應答率86%(24/28)。其中兩例患者達到完全緩解[9]。進一步證明了CSF-1/CSF-1R信號通路的可靶向性。Emactuzumab的副作用主要包括麵部水腫(眶周水腫)、乏力和瘙癢等。
小分子CSF-1R的激酶抑製劑在TCGT患者人群同樣表現出優異的臨床數據,PLX-3397的ORR達到52%(12/23)[10]。與PLX-3397相關的毒性主要包括:疲勞、頭發顏色變化(74%)、惡心、味覺障礙、眶周水腫等。還不是非常確定哪些毒性是與靶向CSF-1R直接相關的。
盡管PLX-3397的選擇性不錯,報道的活性很高,它的PK也相當好,但它的臨床試驗使用劑量達到1000mg/每天。有些懷疑它的活性可能沒有其報道的高。與CSF-1R抗體的更高應答率、更小毒性相比,PLX-3397 的臨床患者有61%還需要通過減少劑量來降低毒性。
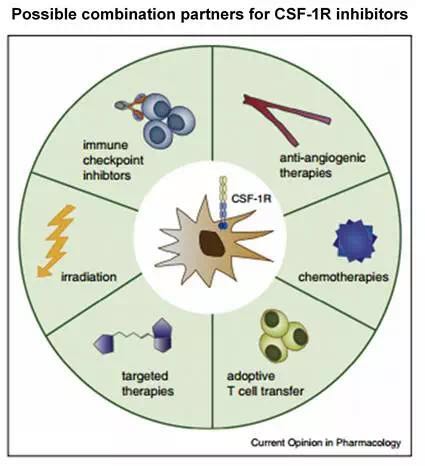
除了上麵提到的TCGT,CSF-1R單用在其它諸多實體瘤的臨床試驗也在開展。目前得到的初步數據不是很積極,單用效果有限。CSF-1R的靶向潛力更多的應該是聯合用藥,與IDO抑製劑的情況類似,能不能達到IDO的聯用效果還有待觀察。
CD47–SIRPα信號通路在調控巨噬細胞的吞噬過程中起重要作用。SIRPα和CD47均屬於免疫球蛋白超家族的成員,分別在巨噬細胞和候選目標細胞中表達。在結合CD47後,SIRPα作為對接蛋白,結合SHP1和SHP2磷酸酶,從而抑製細胞內信號,並由此負調控吞噬作用。因此,CD47的生理作用表現為發布“不要吃我”(Don’t eat me)的信號[11]。
在正常生理情況下,CD47蛋白存在於很多健康細胞的表麵,通過和巨噬細胞表麵的SIRPα(Signalregulatoryprotein-α)結合來告訴巨噬細胞不要去“吞吃”它們,從而保護健康細胞不被清除。當細胞老化或病變時,細胞表麵就會逐漸喪失CD47,巨噬細胞從而能夠識別並處理掉衰老或病變細胞[12]。
而很多腫瘤細胞學會了這個機製,經常過量表達CD47,直接導致TAM不但同腫瘤細胞能夠和平共存,而且TAM還會通過促進腫瘤內血管增殖,抑製效應T細胞發揮作用,促進腫瘤細胞擴增和生長,完全把腫瘤細胞當成自身的愈傷組織來養。
靶向CD47–SIRPα通路的策略主要有兩種,CD47的抗體或SIRPα–Fc重組蛋白。兩種方法均得到臨床前的療效驗證。目前多於4家公司正在開展臨床試驗。初步臨床結果好像也不支持靶向CD47的單用療效[6]。當然,靶向CD47 的潛力是要與免疫療法如PD-1抗體合用,才能充分發揮威力,同樣,道理與IDO的組合療法類似。

同時,CD47靶向藥物在臨床前使用中已被證明與其它不同的抗腫瘤單克隆抗體也有協同作用,包括抗CD20和抗HER2抗體[6]。期待將來的臨床組合療法試驗結果。
與靶向CSF-1R相比,靶向CD47可能會產生更多的靶向相關毒副作用。比如紅細胞上有CD47高表達,打破紅細胞表麵的保護信號,導致巨噬細胞錯誤地清除健康的紅細胞,從而誘發貧血症。其它細胞也有較多的CD47表達,如淋巴細胞、血小板、胎盤、肝和腦細胞等。靶向CD47 的臨床試驗需要密切監視對這些健康細胞,組織可能的毒性損傷。
巨噬細胞的其它靶點
腫瘤細胞可以通過表達趨化因子CCL2、CCL5、CXCL12等促進MDSC和巨噬細胞向腫瘤區域遷移,通過阻斷這些招募通路,可以減少腫瘤浸潤區域中的MDSC和促腫瘤特性的巨噬細胞數量[6,13]。早期臨床試驗表明,CCL2抗體Carlumab,在乳腺癌、肺癌等實體瘤患者中雖然可以良好耐受,單用卻沒有獲得有效緩解。進一步表明,組合療法才能更好的發揮靶向巨噬細胞的威力。
激動劑型的CD40抗體能夠有效的轉化M2巨噬細胞成為M1類型的巨噬細胞,從而起到抑製腫瘤生長、轉移的作用。CP-870893與化療藥物聯用,在胰腺癌臨床試驗中表現出不錯的活性 [14]。
巨噬細胞是腫瘤先天性免疫生態的主要成分之一,在腫瘤的發生、發展和轉移過程中起著關鍵作用。
從初步的腫瘤臨床試驗結果來看,巨噬細胞自搭舞台的表演機會不是很多。組合療法,共享舞台才是巨噬細胞靶向藥物的未來。好在,諸多的臨床前試驗表明,靶向巨噬細胞能夠與各種療法進行組合,包括化療、放療、免疫療法、靶向療法等等,是個不錯的百搭靶點。其組合潛力還需要進一步臨床試驗來驗證。
同時,腫瘤或血液中CSF-1、CSF-1R、CD47的表達量也許是不錯的預測標記物,用來指導組合療法患者的選擇。在個體化治療日益盛行的今天,有選擇性的組合療法代表著未來。
參考文獻:
Immunotherapy: Macrophages steal the show. Villanueva MT. Nat Rev Cancer. 2017, June 23; 17(7):396-397.PD-1 expression by tumour associated macrophages inhibits phagocytosis and tumour immunity. Gordon, S. R. et al. 2017, Nature. 545, 495–499.
In vivo imaging reveals a tumor-associated macrophage mediated resistance pathway in anti-PD-1 therapy. Arlauckas, S. P.et al. Sci. Transl Med. 2017, 9, eaal3604.
Cooperation of immune lymphoid cells with macrophages in tumour immunity. Evans, R. & Alexander, P. Nature. 1970, 228,620–622.
Effects on in vitro tumor growth of murine macrophages isolated from sarcoma lines differing in immunogenicity and metastasizing capacity. Mantovani, A. 1978, Int. J. Cancer 22, 741–746.
Tumour-associated macrophages as treatment targets in oncology. Mantovani A, Marchesi F, Malesci A, Laghi L, Allavena P. Nat Rev Clin Oncol. 2017, Jul;14(7):399-416.
CSF-1/CSF-1R targeting agents in clinical development for cancer therapy. Ries CH, et. al. Curr Opin Pharmacol. 2015, 23:45-51.
Targeting tumor-associated macrophages with anti-CSF-1R antibody reveals a strategy for cancer therapy. Ries CH, et. al. Cancer Cell. 2014, 25(6):846-859.
CSF1R inhibition with emactuzumab in locally advanced diffuse-type tenosynovial giant cell tumours of the soft tissue: a dose-escalation and dose-expansion phase 1 study. Cassier PA et al. Lancet Oncol. 2015, 16(8):949-956.
Structure-Guided Blockade of CSF1R Kinase in Tenosynovial Giant-Cell Tumor. William D. Tap, M.D., Zev A. Wainberg, et. al. N Engl J Med. 2015, 373:428-437.
CD47-blocking antibodies restore phagocytosis and prevent atherosclerosis. Kojima Y, et al.2016, Nature 536:86-90.
CD47 blockade as another immune checkpoint therapy for cancer. Vonderheide RH. Nat Med 2015, 21:1122-1123.
Targeting tumour-associated macrophages with CCR2 inhibition in combination with FOLFIRINOX in patients with borderline resectable and locally advanced pancreatic cancer: a single-centre, open-label, dose-finding, nonrandomised, phase 1b trial. Nywening, T. M. et al. Lancet Oncol. 2016,17:651–662.
A phase I study of an agonist CD40 monoclonal antibody (CP-870,893) in combination with gemcitabine in patients with advanced pancreatic ductal adenocarcinoma. Beatty, G. L. et al. Clin. Cancer Res. 2013, 19:6286–6295.
 相關新聞
相關新聞