哪些潛力大、哪些式微、哪些風險大?孤兒藥還是不是捷徑?
當前,製藥行業出現了越來越多孤兒藥,對於免疫腫瘤藥物的熱情也愈加高漲。在對熱點研發領域保持密切關注的同時,企業還是要盡量做到克製,要確保研發活動行進在正確的方向上。
本文對Pharmaprojects數據庫不同作用機理、靶點的在研項目數量進行排序,透過研發熱點分析其中包含的研發趨勢。
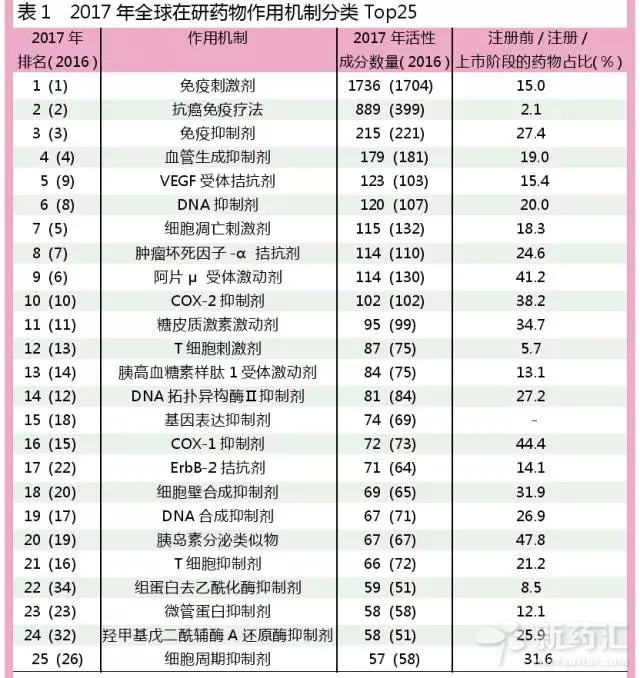
作用機理Top 25:抗癌免疫療法醞釀研發風暴
從在研藥物的作用機製來看,目前排名居前五位的作用機製包括免疫刺激劑(1736)、抗癌免疫療法(889)、免疫抑製劑(215)、血管生成抑製劑(179)和VEGF受體拮抗劑(123)。通過對在研藥物作用機製的分析,可使我們深入理解在研藥物的開發策略以及新的疾病治療方式。
抗癌免疫療法為2015年初新增加的作用機製分類,該類別包括免疫腫瘤藥物,以及一些相關的給藥策略。目前已發現的新抗癌藥物,可被引入人體自身免疫係統以治療癌症,並且該藥物可利用人體中一係列的靶標。因此,抗癌免疫作用機製適用於所有的免疫腫瘤藥物,包括大約40種不同的藥物作用機理,例如PD-1拮抗劑、TIM3拮抗劑,以及一係列CD細胞亞型拮抗劑等。
目前該類別的在研藥物數量,已從2016年的399種增加至2017年的889種,增幅高達123%,在如此短的時間內出現這樣高的增長幅度,也是前所未有的。
需要注意的是,該類藥物中,僅有2.1%的藥物處於注冊前、注冊或上市階段,如果更多藥物成功上市或繼續保持如此高的增長速度,未來該類藥物可能會掀起一場研發風暴。目前免疫腫瘤學發展勢頭十分迅猛,未來很有可能創造出與化學合成小分子藥物類似的成就。
與往年的作用機製Top25榜單相比,其他類別品種的數據未見明顯變化,許多類別僅僅是增加了一些候選藥物。或許,應當將更多的注意力集中在藥物研發的主要靶標上。有趣的是,由於免疫腫瘤作用機製類別過於多樣化,以致於在藥物作用靶標蛋白Top 25名單中未見免疫腫瘤靶標。
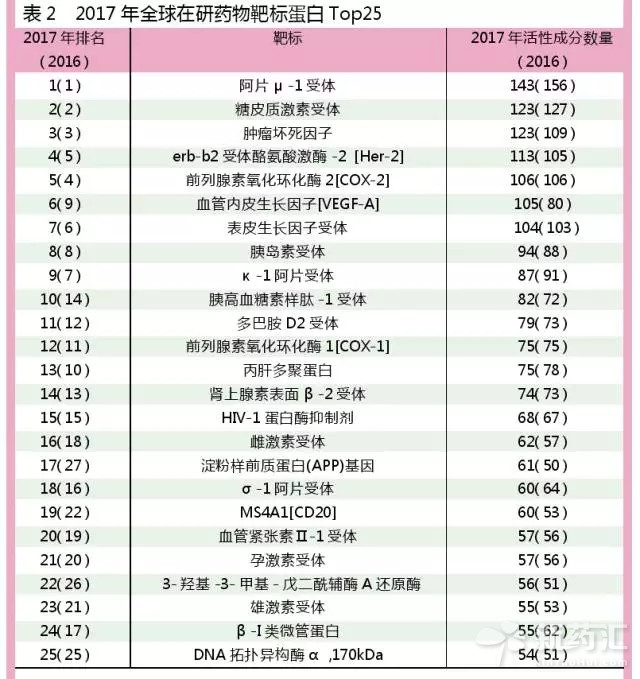
在研靶點Top 25:創新程度高於近十年平均水平
從藥物作用的靶標蛋白來看,疼痛的主要作用靶點——阿片μ受體,仍是在研藥物中最重要的作用靶標,2017年其在研藥物數量與2016年數據相比,已從156個下降至143個;糖皮質激素受體仍然位居第二位,活性成分數量為123個;腫瘤壞死因子、Her-2、前列腺素氧化環化酶2(COX-2)則分別位列第三至第五位。
在Top10藥物靶標蛋白中,增幅較為明顯的靶標主要為癌症靶標。例如,作用於血管內皮生長因子[VEGF-A]的活性藥物數量,已從2016年的80個增加至105個,增幅高達31.3%,其排名已從2016年的第9位升至第6位。
此外,排名變化較大的靶點還有澱粉樣前質蛋白(APP)基因,2017年其排名已從第27位躍升至第17位。該靶標是與阿爾茨海默病治療相關的靶點,但與該靶標相關的治療藥物Solanezumab臨床Ⅲ期研究已被禮來公司宣告失敗。由於在疾病病理學方麵,澱粉樣蛋白假說的準確性仍存在相當大的爭議,所以在一些地方人們並未真正理會這些失敗的案例,對於該靶標,行業仍在投入大量資金。
在當前的研發管線中,所有在研藥物所涉及的靶標蛋白共計1672個,而截至目前已經確定的靶標蛋白數量累計已達2774個。
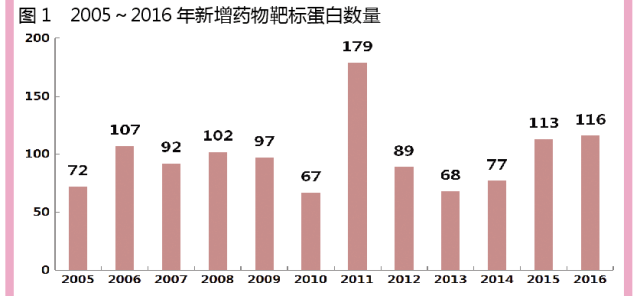
每年新增靶標蛋白的數量,可以作為衡量新藥研發行業創新程度的一個重要指標。在過去的12個月中,行業新發現的靶標蛋白數量為116個,與去年數據(113個)基本一致。從2005-2016年靶標蛋白數量變化情況分析,在靶點創新方麵,2016年行業的整體表現要好於近十年平均水平,行業藥物創新正在逐漸加速。
各種“快車道”:“孤兒藥”數量減少,但仍是捷徑
從各方麵數據來看,製藥研發行業正在不斷壯大,研發產品線正在進一步擴張。另一方麵,關於製藥行業研發創新難度不斷增加的認識,已為眾多業內人士所認同。毫無疑問,在製藥行業,同樣存在著生存和選擇壓力。慶幸的是,目前製藥行業已經將注意力集中在了罕見病或具有未滿足臨床需求的疾病領域。
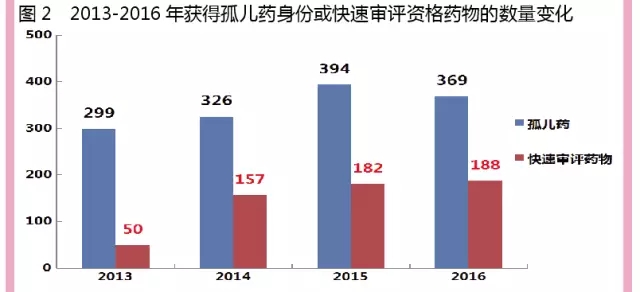
為推動在研藥物盡快上市,全球的製藥研發企業均在尋找加快藥品審評審批的途徑。目前,全球用於加快藥品審評的措施主要有獲得孤兒藥身份和快速審評藥物資格兩種方式,例如“快速審評資格”及“突破性療法”認定。
2013-2016年統計數據顯示,每年獲得孤兒藥和快速審評藥物資格的藥物數量逐年增加,孤兒藥數量已從2013年的299個增加至2016年的369個,快速審評藥物數量已從2013年的50個增加至2016年的188個。盡管與2015年數據相比,2016年孤兒藥的數量出現了小幅下滑,但是通過“孤兒藥”身份獲得快速審評資格的方式,目前仍是推動藥物快速上市的有效路徑。
除“快速審評資格”及“突破性療法”認定外,當前藥品快速審評機製還包括:美國目前施行的優先審評、加速審批、靈活的臨床開發計劃和合格傳染病認證產品(QIDP)資格等製度,歐盟施行的加速審評製度,以及英國施行的突破性創新藥物(PIM)製度。
從當前製藥研發及藥品審評審批現狀來看,對於製藥研發企業而言,所有這些製度和策略都具有極大的吸引力。
結語<<<
考慮到美國醫保政策變化可能會對全球藥物研發格局帶來一定的不確定性,製藥研發企業應保持謹慎態度,充分理解全球在研新藥發展的新特點,結合企業自身發展的優、劣勢,合理調整產品發展管線,積極降低新藥研發過程中所存在的各種風險,提高研發回報率。研發企業在夯實產品研發基礎的同時,也要注重產品研發策略及商業並購策略的應用,並應注意通過多種方式優化產品管線結構,不斷提高企業新藥研發的綜合競爭力。















 相關新聞
相關新聞