FDA拒絕Coherus對安進重磅生物藥的仿製申請
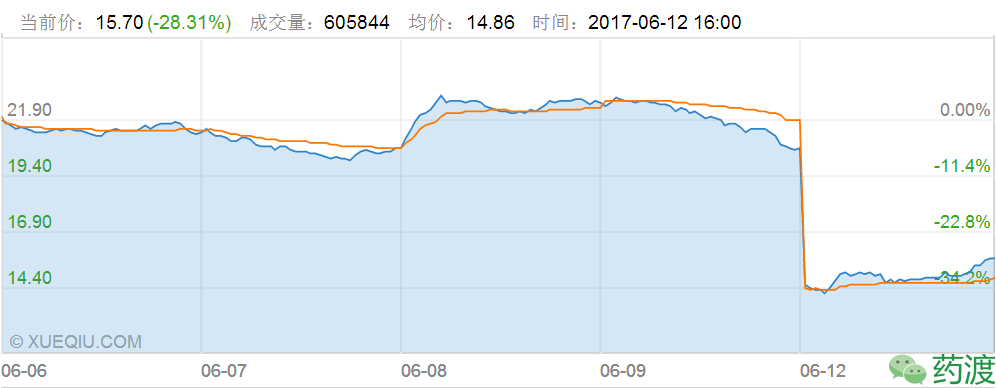
2017年6月12日,Coherus宣布美國食品藥品監督管理局(FDA)拒絕其生物類似藥CHS-1701(Neulasta的仿製藥物)的生物製劑許可證申請,該公司股價應聲下跌27%(圖1)。一年前,FDA也曾拒絕諾華對Neulasta的仿製申請,當時就有人指出,FDA如此行事會極大影響公司,甚至整個生物製藥行業,因為它讓公司無法對行業的規章進行有效預測,增加了信息的不透明度和成本。
圖1. Coherus股票價格
FDA在其回應信中要求Coherus進行樣本再分析並提供更多相關製造流程信息,但並未要求該公司進行臨床研究或額外GMP鑒定。
Coherus的董事長兼CEO Denny Lanfear回應道;“我們雖然對這樣的結果不滿意,但是我們有信心能夠給FDA滿意的答複,從而使CHS-1701順利獲批,令我們欣慰的是,FDA沒有額外要求臨床試驗,我們相信我們能夠很快解決問題,並在下個月與FDA相關人員繼續洽談後續事宜,Neulasta是以上市用以治療腫瘤的生物製劑,我們相信將來CHS-1701的獲批會為美國患者帶來巨大福利“。
安進Neulasta於2002年1月31日獲得美國食品藥品管理局(FDA)批準,2002年8月22日獲得歐洲藥物管理局(EMA)批準,2014年9月26日獲得日本醫藥品醫療器械綜合機構(PMDA)批準上市,並由安進在美國和歐洲市場銷售,商品名為Neulasta和Ristempa(也由日本協和發酵麒麟株式會社在日本市場銷售,商品名為G-Lasta)(圖2)。
圖2 安進的Neulasta
作為安進的主力產品,Neulasta上市第一年就取得4.64億美元的銷售,創下了2002年入市美國新藥年銷售額的最高紀錄。2013年Neulasta的銷售額達到43.92億美元,十二年的時間內銷售額增加了近9倍,年複合增長率高達20.6%。目前,Neulasta每年為其帶來50億美元收入,且主要來自美國本土(圖3)。CHS-1701正是在Neulasta專利到期後準備進入市場的眾多仿製藥中的一員。
圖3. 2002至2013年Neulasta銷售額
來源:招商證券-快速增長的生長激素市場—強者恒強
Pegfilgrastim (Neulasta)是一種聚乙二醇化的重組人粒細胞集落刺激因子(參考藥渡數據庫),能調節骨髓中性粒細胞的產生,並影響中性粒細胞前體的增殖、分化和功能。該藥用於治療非髓性惡性腫瘤患者發熱性中性粒細胞減少症(圖4)。Neulasta和Ristempa是皮下注射液,含6 mg/0.6 mL Pegfilgrastim。推薦劑量為每次6 mg,每個化療療程一次。G-Lasta是一種皮下注射液,含3.6 mg/0.36 mL Pegfilgrastim。推薦劑量為每次3.6 mg,每個化療療程一次。
圖4. Pegfilgrastim
Coherus致力於提供生物仿製藥物產品的研發借以治療慢性及危及生命的疾病。除了CHS-1701,還有其他在研產品。
CHS-0214:Etanercept的生物仿製藥,用於治療類風濕關節炎和牛皮癬,以及強直性脊柱炎,幼年發特發性關節炎,銀屑病性關節炎,目前處於Ⅲ期臨床試驗階段。
CHS-3351:Ranibizumab(蘭尼單抗)的生物仿製藥,用於新生血管年齡相關性黃斑變性,以下視網膜靜脈阻塞性黃斑水腫,糖尿病性黃斑水腫,糖尿病性視網膜病和潰瘍性結腸炎的治療,目前處於臨床前研究階段。
CHS-1420:Adalimumab的生物仿製藥,治療強直性脊柱炎,貝切特式病,克羅恩式病,幼年發特發性關節炎,銀屑病,銀屑病關節炎,類風濕性關節炎,潰瘍性結腸炎。
CHS-5217:Bevacizumab 的生物仿製藥,治療轉移性結腸直腸癌,非小細胞肺癌,轉移性腎癌,晚期宮頸癌,鉑類耐藥卵巢癌和複發成膠質細胞癌。
總結
1、原研藥的發展使得患者在健康與疾病之間有了選擇。
2、仿製藥的發展使得患者在不同價格的治療方案之間有了選擇。
3、有選擇是件多麽美妙的事情。

分享到:

















 相關新聞
相關新聞