“第10號藥物臨床試驗數據現場核查計劃公告”與“擬納入優先審評程序藥品注冊申請的公示(第十四批)清單”都在3月3日同一天發布。
那麽,備受業界關注的臨床現場核查通過率到底是多少?優先審評清單究竟藏著多少玄機?為此,筆者對臨床數據現場核查的10個公告,以及優先審評的所有14批清單的數據進行匯總分析。
現場核查計劃
第10號藥物臨床試驗數據現場核查計劃公告,也是2017年發布的第二號藥物臨床試驗數據現場核查計劃。清單中的32個受理號來自進口產品的共27個,國內產品僅5個。
值得注意的是,所有藥物臨床試驗數據現場核查計劃公告所涉及的受理號都是來自CFDA所公布的臨床自查核查目錄,第10號藥物臨床試驗數據現場核查計劃公告首次納入來自第五批自查目錄的產品。
現場核查通過率約22.5%
對10個藥物臨床試驗數據現場核查計劃公告進行數據分析的結果顯示,12%的第一批自查核查目錄受理號、20%的第二批自查核查受理號、41%的第三批自查核查受理號、25%的第四批自查核查受理號以及36%的第五批自查核查受理號,已被列入藥物臨床試驗數據現場核查計劃中。
表1 藥物臨床試驗數據現場核查計劃受理號對應的自查目錄批次
(信息來源:鹹達數據V3.2)
截至2017年3月9日,鹹達數據V3.2號發現,十個現場核查計劃公告中的278個受理號中,有73個受理號已製證完畢,其中43個受理號數2016年已製證完畢,這意味著對應的受理號早已拿到臨床批件或生產批件了。除了3個臨床申報,2016年共有9個生產批文被公布獲批,這意味著藥物臨床試驗數據現場核查的通過率約為22.5%。
表2 藥物臨床試驗數據現場核查計劃公告受理號狀態
(信息來源:鹹達數據V3.2)
生產批文獲批率目前僅3.6%
截至2017年3月9日,鹹達數據V3.2發現藥物臨床試驗數據現場核查計劃清單中共有10個生產批文獲批,僅占約3.6%。其中,隻有齊魯製藥(海南)的吉非替尼片在優先審評品種名單中。
第10號藥物臨床試驗數據現場核查計劃公告中,共有4個產品曾被納入優先審評品種名單,分別為諾華的沙庫巴曲纈沙坦鈉片、拜耳的利奧西呱片、西安楊森的伊布替尼膠囊、默沙東的口服五價重配輪狀病毒減毒活疫苗(Vero細胞)。沙庫巴曲纈沙坦鈉片、利奧西呱片和伊布替尼膠囊獲得優先審評理由都是“與現有治療手段相比具有明顯治療優勢”。口服五價重配輪狀病毒減毒活疫苗(Vero細胞)獲得優先審評的理由是兒科用藥。
表3 第10號藥物臨床試驗數據現場核查計劃公告中納入優先審評品種的受理號
(信息來源:鹹達數據V3.2)
優先審評清單
第14批擬納入清單分析
首提“不再公示”的情況
在3月3日公布的擬納入優先審評程序藥品注冊申請的公示(第十四批)清單中,CDE首次提出,對前一輪申報時(如申請臨床試驗)已被納入優先審評的注冊申請,再次申報後(如申請上市)仍提出優先審評申請的,其優先審評申請的理由和依據前後一致且具有明顯臨床價值的,經專家審核後直接納入優先審評不再公示。
阿斯利康投資(中國)申報的甲磺酸奧希替尼片(受理號JXHS1700005、JXHS1700006)用於治療非小細胞性肺癌,與現有治療手段相比有明顯治療優勢,已在前一輪申報被納入優先審評(JXHL1600100,JXHL1600101),本輪申報上市並提出優先審評申請,經專家審核符合上述條件,直接納入優先審評。然而,諾華沙庫巴曲纈沙坦鈉片(受理號JXHS1600023、JXHS1600021和JXHS1600022)在2016年12月已納入優先審評,第十四批又申請了3個優先審評(受理號JXHS1600083、JXHS1600084和JXHS1600085)。
“具明顯治療優勢”近半
共21個受理號被納入第十四批優先審評程序藥品注冊申請的公示清單,其中12個為新藥上市,7個申請新藥臨床試驗,2個為仿製藥上市。僅有德穀胰島素注射液(受理號JXSS1500010和JXSS1500011)來自自查核查目錄,為第二批自查核查目錄內產品。
“與現有治療手段相比具有明顯治療優勢”“兒童用藥”“丙型肝炎直接抗病毒治療藥物”“抗艾滋病藥物”和“首仿”是目前申請優先審評審批的主要理由。
優先審評理由是“與現有治療手段相比具有明顯治療優勢”的有10個受理號,“兒童用藥”有2個受理號,“丙型肝炎直接抗病毒治療藥物”對應5個受理號,“抗艾滋病藥物”有2個受理號,“臨床急需、市場短缺、首仿”和“臨床急需、市場短缺”各有1個受理號。
所有已納入清單分析
截至2017年3月9日,共有177個受理號最終被納入優先審評,分別有82個進口受理號,95個國內受理號。化藥受理號為157個,治療用生物製品受理號有17個,預防用生物製品受理號有2個,中藥受理號有1個。
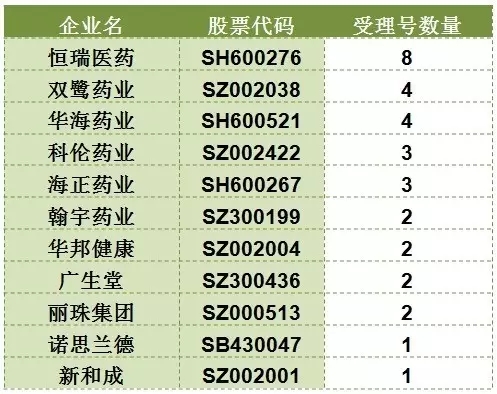
恒瑞領銜A股上市公司
177個受理號中,有2個已標記為“重大專項”,已標記為“加快品種”受理號數共109個,已標記為“特殊審批”受理號數22個。
比較已上市企業納入優先審評名單的受理號數發現,恒瑞醫藥以8個受理號數排名第一,對應產品為醋酸卡泊芬淨、釓布醇注射液、磺達肝癸鈉及注射液、帕立骨化醇及注射液、鹽酸右美托咪定鼻噴霧劑和注射用醋酸卡泊芬淨。雙鷺藥業和華海藥業並列第二。雙鷺藥業的主要產品是來那度胺及膠囊,華海藥業則是纈沙坦片。
表4 已上市企業納入優先審評名單的受理號數量排名
(信息來源:鹹達數據V3.2)
“首仿”納入數量最多
“首仿”是獲得優先審評的理由中對應受理號數最多的,共32個製劑,如貝美前列素滴眼液、丙酸氟替卡鬆鼻噴霧劑、布地奈德福莫特羅粉吸入劑(膠囊型)、布林佐胺滴眼液、布洛芬注射液、醋酸加尼瑞克注射液、丁酸氯倍他鬆乳膏、複方氟米鬆軟膏、富馬酸替諾福韋二吡呋酯膠囊、釓布醇注射液、釓塞酸二鈉注射液、鈣泊三醇倍他米鬆軟膏、枸櫞酸咖啡因注射液、磺達肝癸鈉注射液、吉非替尼片、拉坦噻嗎滴眼液、洛索洛芬鈉凝膠膏、氯法拉濱注射液、氯替潑諾妥布黴素滴眼液、米卡芬淨鈉、帕立骨化醇注射液、曲伏前列素滴眼液、曲伏噻嗎滴眼液、他克莫司滴眼液、吸入用乙酰半胱氨酸溶液、鹽酸決奈達隆片、鹽酸莫西沙星片、注射用醋酸卡泊芬淨、注射用醋酸西曲瑞克、注射用米卡芬淨鈉、注射用帕瑞昔布鈉和注射用硼替佐米。
最終獲得優先審評兒童用藥的製劑有15個,分別為甘精胰島素注射液、托珠單抗注射液、度拉糖肽注射液、口服五價重配輪狀病毒減毒活疫苗(Vero細胞)、鹽酸利多卡因粉末無針經皮注射給藥係統、鹽酸托莫西汀口服溶液、鹽酸右美托咪定鼻噴劑、重組人血小板生成素注射液、注射用米法莫肽鈉脂質體、左乙拉西坦注射用濃溶液、兒童用法羅培南鈉幹糖漿、鹽酸普萘洛爾口服溶液、枸櫞酸咖啡因注射液、氯法拉濱注射液和麥格司他膠囊。
適應症與丙肝相關並獲得優先審評的有14個製劑:ASC16片、Asunaprevir膠囊、DaclatasvirDihydrochloride片、KW-136膠囊、SH229片、阿舒瑞韋軟膠囊、奧比帕利片、達塞布韋片、丹諾瑞韋鈉片、伏拉瑞韋膠囊、來迪派韋索磷布韋片、索磷布韋片、西美瑞韋膠囊和鹽酸達拉他韋片。
阿達木單抗注射液、阿法替尼片、奧希替尼片、苯烯莫德乳膏、達比加群酯膠囊、德拉馬尼片、甲苯磺酸索拉非尼片、甲磺酸奧希替尼片、甲磺酸雷沙吉蘭片、利奧西呱片、利伐沙班片、沙庫巴曲纈沙坦鈉片和伊布替尼膠囊納入優先審評名單的理由是“與現有治療手段相比具有明顯治療優勢”。
總結<<<
臨床自查核查已進入常規化,目前製證完畢的產品數有限,最後獲批生產的幾率較低。申報數量遞減下,預計新產品上市數也較少。
優先審評以首仿藥為主,體現了我國急於替代過期原研藥的導向,CFDA審批更注重質量而非數量,仿製藥項目質量決定了能否上市。鑒於同通用名仿製藥的排隊數眾多,首仿上市不一定是排隊靠前的,但一定是質量過關的。

















 相關新聞
相關新聞