當今,在這四海八荒“大眾創業、萬眾創新”的大勢之下,藥品行業似乎也正在融入這盛世當中。然而,雖仿製藥的研發似進入其發展規律中的“天劫”,但這並不意味著創新藥物將被那傳說中的72隻五彩鳥縈繞而起,畢竟“firstinclass”的產品需要一點一滴的曆經各種“劫難”而生。不過,借此洪澤,深耕於創新藥物開發,打下更為牢固的基礎,相信還是極好的事情。今天,在下鬥膽在此淺談一下,創新藥物開發過程中,關於“前藥”的些許思路。
前藥的由來及基本特征
前藥(prodrug),一詞最早由AdrienAlbert於1958年提出,當時是用來描述某個經生物轉化後可產生具有藥理作用的化合物所引用的概念。一直以來,前藥被定義為本身無活性,但可轉化成一個或多個活性代謝產物的化合物。直到後來,Rautio等又進一步完善了前藥的定義,即:在體內經過酶或化學作用釋放出可達到預期藥理活性的母體藥物分子的可逆性衍生物。這裏需強調的是,前藥沒有活性或活性較母體藥物小得多。前藥設計在克服藥物用藥障礙、增強化學及代謝穩定性、提高水溶性或脂溶性、增加口服或者局部給藥的吸收度、增強血腦屏障滲透性、延長作用時間、提高生物利用度,以及減輕不良反應等應用中,已經成為一種被廣泛接受的有效策略。
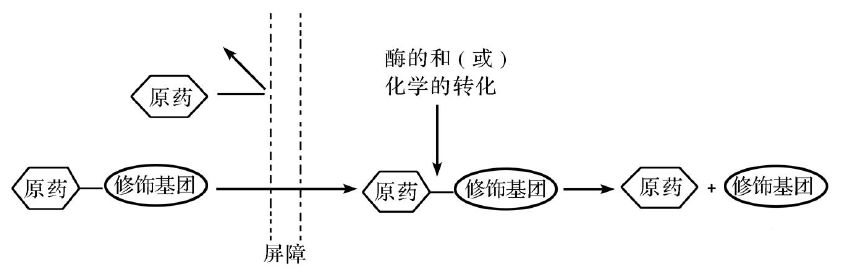
設計前藥分子時,應考慮什麽?
一旦選擇前藥作為研究方向,接下來將麵臨其設計及開發等一係列具體問題的挑戰。理論上,在設計一個合理的前藥分子時,一定要清楚前藥可能會改變藥物原來的組織分布、功效和毒性。設計前藥分子結構時,對於母體藥物,哪些官能團可以被有效修飾?對於修飾基團,引入的修飾基團又是否安全?在體內能否被快速清除?病情、用藥劑量及療程情況到底怎樣?對於原藥和前藥,它們的吸收、分布、代謝、排泄等藥代動力學信息和特征到底是怎樣的?對於分解副產物,它們是否會影響原藥化學和物理學方麵的穩定性?是否還會生成新的分解副產物?等等等等……都需要藥學工作者去一一了解以及攻克!
通常,簡單的前藥設計,母體藥物分子中的各種官能團均有可能成為被修飾的對象。例如,含有羧基和羥基的化合物可修飾為酯類(如羧酸酯和磷酸酯等)前藥;含氮化合物可修飾為酰胺、亞胺、N-Man-nich堿、N-酰氧烷基衍生物、Schiff堿、肟和烯胺酮等前藥;含羰基化合物可修飾為Schiff堿、肟、唑烷、噻唑烷和烯醇酯;等等等等……當然,這需要建立在清晰的藥物代謝信息的基礎之上。
前藥設計思路對“不良”藥物有何改善?
首先,是改善藥物的水溶性。水溶性差是限製藥物口服吸收的重要原因,也是藥劑學者經常麵對的挑戰。藥物經過修飾形成前藥後一般具有帶電基團(如酯類前藥中的磷酸酯、單琥珀酸酯、氨基酸酯及二甲氨基乙酸酯等)或親水基團(聚乙烯-乙二醇共聚物及PEG等)。需要注意的是在增加前藥水溶性時需要協同考慮前藥的脂溶性,脂溶性太差的前藥不能提高口服吸收。在這裏,強調下幾種載體。磷酸酯類載體通常具有良好的溶解性、化學穩定性外以及適用於靜脈注射與口服給藥;而氨基酸或多肽類前藥載體在此基礎上,還可廣泛用於各種胺類和醇類藥物的結構修飾且口服生物利用度較高;另外,糖苷類載體除了能提高藥物水溶性外,有些糖苷能起到一定的靶向作用。
其次,是改善藥物的脂溶性。低水溶性是藥物生物利用度低的原因之一,但是高水溶性而脂溶性很低也影響其成藥性。藥物經口服進入胃腸道後需要通過小腸黏膜才能進入人體循環,隻有具有一定的脂溶性才能被吸收。脂溶性對中樞神經係統藥物尤其重要,藥物隻有通過人體血腦屏障並達到一定的濃度才能發揮作用,脂溶性與滲透性是關鍵參數。通過增加藥物脂溶性、提高滲透性,以及改善脂水分配係數而提高小腸的被動吸收與血腦屏障穿透率是最常用的前藥設計策略之一。
再次,是改善肝髒與小腸的代謝。肝髒和小腸的首過作用是藥物口服吸收的重要生理屏障,通過改變藥物代謝的途徑來減緩代謝,能顯著改善藥物的藥代動力學特征,其主要方法是將容易被代謝的基團通過適當的修飾加以保護。這類前藥,雖仍可以被血液、肝髒、肺及其他組織中的乙酰膽堿酯酶降解,但卻明顯延長了藥物的作用時間。
最後,是改善藥物的靶向性。前藥是母藥分子不活潑的衍生物,在體內能自發的或通過某些酶降解釋放出有活性的母藥。因此,能通過改變靶器官的pH值和某些酶的活性來實現母藥的定位釋放。如動物實驗研究發現,甘氨酸-水楊酸前藥在胃腸道上部被吸收,並進入體循環;但穀氨酸-水楊酸前藥因為載體氨基酸的親水性較好,因此,通過膜的量減少,在胃腸道上部很少被吸收,是一個較好的結腸靶向釋藥係統(口服結腸靶向是前藥靶向釋藥係統中的主要應用)。
再簡單聊聊前藥的“藥代動力學”!
前藥在體內轉化成活性成分的速度和程度是其發揮藥效作用的關鍵。對於不同類別的前藥,首先必須進行二個方麵的研究。一是前藥的穩定性研究,包括前藥的化學穩定性和代謝穩定性研究兩部分。前藥的化學穩定性研究即考察前藥在不同pH值緩衝液(如人工腸液或胃液)中的穩定性;而前藥的代謝穩定性研究即為前藥轉化為原藥的研究,包括轉化過程中涉及的代謝酶及轉化速率研究。例如許多前藥是經由血漿或組織中的酯酶如堿性磷酸酯酶、羧酸酯酶等水解為原藥後發揮作用,因而對前藥在不同種屬間血漿和組織中穩定性的考證成為研究這類前藥代謝性質的一個重要方麵。
一般來說磷酸酯類前藥穩定性較好,在體內經由肝腸中的磷酸酯酶水解後迅速轉化為原藥,並且磷酸酯類前藥在不同的臨床前物種間的水解速率近似;而對於經由羧酸酯酶水解的前藥,由於羧酸酯酶在齧齒類動物血漿中含量較高,因而此類前藥在不同種屬間會表現出明顯的水解速率差異。由於種屬差異的存在,前藥在不同種屬體內的轉化速率可能存在很大的差別,而臨床前藥代動力學結果可能不能反映人體的藥代動力學特性,因此采用體外模型進行前藥的人體藥代動力學特性預測至關重要。
二是對於不同給藥方式的前藥,應在臨床前整體動物試驗水平上盡可能同時進行血管內給予原藥的試驗,提供前藥給藥後體內原藥的絕對生物利用度;並且為了證明前藥的藥效、藥劑或藥代動力學性質確實優於原藥,在試驗設計上應盡可能提供原藥對照組的藥代動力學參數,即給出與前藥等摩爾劑量的原藥給藥後原藥在體內的吸收和排泄情況,與前藥給藥後原藥在體內的相應參數進行比較。
小結
在新藥的創製過程中,藥學工作者將麵臨諸多方麵的挑戰,而是否選擇前藥來作為開發方向,這就是一個挑戰。前藥策略雖能改善藥理活性化合物的物理化學、生物藥劑學、藥代動力學性質,以及增加藥物研發的可靠性和有效性等等,但由於前藥的研究涉及到不同於“正常”藥物諸如合成、藥效、藥代及毒理等方麵的研發過程,故而必須慎重選擇。不過,前藥也正是憑借其優於原藥的溶解性、化學穩定性、口服吸收性、代謝緩慢、腦部滲透適當、較小的副作用/毒性等特點,也越來越受到製藥公司和科研機構的青睞。其實,不論哪種類型藥物的開發,隻要能尋找到那安全、有效、質量可控的創新藥物,便都是極好的事情,正所謂“三月春盛,煙煙霞霞,灼灼桃花雖有十裏,但一朵放入掌心,足矣”。
參考文獻:
1. Tomi J,Jarkko R,Mar M,et al. Design and Pharmaceutical Applications of Prodrugs [J]. Wiley,2005.
2. Kristiina MH, Jukka L, Jouko V,et al. In vitro and in vivo evaluation of a sulfenamide prodrug of basic metformin [J].JOURNAL OF PHARMACEUTICAL SCIENCES,2012.
3. Paul WE,Rahul K,Jeffrey G,et al. Prodrugs:Strategic Deployment,Metabolic Considerations,and Chemical Design Principles [J].BURGER'S MEDICINAL CHEMISTRY AND DRUGDISCOVERY,2010.
4. Han VW,Bernard T. Prodrugs[B]. DRUG BIOAVAILABILITY: ESTIMATION OF SOLUBILITY,PERMEABILITY,ABSORPTION AND BIOAVAILABILITY,2009.
5. Testa B,Mayer JM. Introduction: Metabolic Hydrolysis and Prodrug Design[J]. Verlag Helvetica Chimica Acta,2006.
6. 朱胤慈,孫建國,彭英,等. 前藥的藥代動力學研究進展[J].中國臨床藥理學與治療學,2012.
7. 操鋒,平其能,陳軍.口服前藥研究:機遇與挑戰[J]. 藥學學報,2008.
















 相關新聞
相關新聞