
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




根據《國務院辦公廳關於開展仿製藥質量和療效一致性評價的意見》(國辦發〔2016〕8號)(以下簡稱“8號文”)政策要求,化學藥品新注冊分類實施前(2016年3月)批準上市的仿製藥,凡未按照與原研藥品質量和療效一致原則審批的,均須開展一致性評價。其中,國家基本藥物目錄(2012年版)中2007年10月1日前批準上市的化學藥品仿製藥口服固體製劑,應在2018年底前完成一致性評價。根據CFDA上市藥品數據庫批文數量統計,需要進行一致性評價的仿製藥品約涉及11.6萬個批文,原則上應在2018年前完成一致性評價的仿製藥品涉及17740個批文、1800多家企業,仿製藥一致性評價的時間緊迫。
仿製藥一致性評價工作從參比製劑備案到最終獲批預計需要20~28個月,如果按照2016年3月5日國家出台第一份政策文件算起,以2018年底為節點,目前一致性評價賽程已經過半。從BE備案到最終通過一致性評價約需13個月時間,預計多數品種已經或正要進入BE試驗,BE高峰即將來臨。2017年底至2018年初,中國有望迎來第一批通過仿製藥一致性評價的品種。BE試驗約需7個月。12月5日,據中國生物製藥的公告,其富馬酸替諾福韋二吡呋酯片獲藥品注冊批件。該公告稱,這是國內首個按照一致性評價標準完成生物等效性研究的仿製藥。
截至2017年10月15日,已有京新藥業的瑞舒伐他汀鈣片(10mg)等35項BE試驗完成。完成BE試驗後,企業將向CDE進行仿製藥一致性評價申請。目前,京新藥業的瑞舒伐他汀鈣片(10mg)、石藥集團的阿莫西林膠囊(0.5g)、信立泰的硫酸氫氯吡格雷片(75mg)、正大天晴的厄貝沙坦氫氯噻嗪片(150mg/12.5mg)與瑞舒伐他汀鈣片(10mg)、揚子江藥業的馬來酸依那普利片(10mg)、江西青峰的恩替卡韋分散片(0.5mg)等多個品種已報送CDE,預計2017年底至2018年初將有第一批仿製藥品種通過一致性評價。
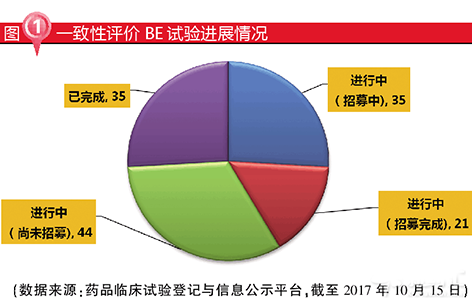
由於優先通過一致性評價的品種將享受優先采購、醫保支付、資金支持等政策支持,因此通過一致性評價的品種有望實現快速放量。筆者認為,大普藥、重磅藥、大領域是三種受到一致性評價政策影響較大的類別。本文選取BE試驗備案企業最多的阿莫西林膠囊、市場超大品種氯吡格雷,以及心血管領域重點品種瑞舒伐他汀為代表品種,對三類產品的特征和未來趨勢進行詳細解讀。
大普藥品種的特點是,市場規模大、原研份額較小、國內企業眾多但缺少絕對龍頭。筆者選取BE試驗開展最多的品種阿莫西林膠囊為此類的代表品種進行分析。截至寫稿日,共有8家企業開展阿莫西林膠囊的BE試驗。
阿莫西林於1972年上市,是一種比較成熟、應用廣泛的半合成青黴素。膠囊劑因溶出度較好、價格低廉成為其主要劑型,根據IMS數據統計,膠囊劑型2016年占比67%。國內生產廠家眾多,據CFDA數據,約有140家企業持有阿莫西林膠囊生產文號。
從市場競爭格局來看,據IMS數據統計,2016年阿莫西林膠囊全國銷售金額為1.3億元,聯邦製藥市場份額較高。但是,由於澳美製藥近年加大市場推廣力度,市場份額逐漸擴大,聯邦製藥的阿莫西林膠囊市場份額近三年來不斷縮小,並有進一步被壓縮的趨勢。不過,聯邦製藥阿莫西林膠囊的仿製藥一致性評價申請於2017年9月1日報送CDE受理。受益於一致性評價,聯邦製藥有望鞏固甚至擴大現有市場地位,從而實現該品種的強勢突圍。

重磅藥類別,是指市場規模巨大、一直以來原研藥占主導地位且競爭格局良好的品種類別。筆者選取氯吡格雷為本類藥物的代表品種。
氯吡格雷作為一種心腦血管領域的經典抗凝藥,市場規模巨大,根據IMS數據統計,2016年氯吡格雷市場規模約69億元,僅有3家企業生產,其中原研企業賽諾菲(波立維)市場份額約60%,具有主導地位,國內企業信立泰(泰嘉)約30%,樂普醫療(帥克)約10%,呈現“三分天下”的競爭格局。
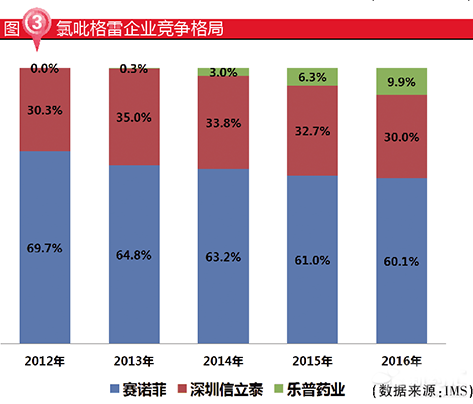
在氯吡格雷一致性評價競爭中,信立泰75mg氯吡格雷已經完成現場檢查,一致性評價申請已在2017年7月25日獲得CDE受理,預計2018年上半年可通過一致性評價。
而樂普醫療75mg氯吡格雷BE試驗正在招募中,預計2018年中通過一致性評價,緊跟信立泰。由於樂普醫療目前市場份額僅占10%左右,若通過一致性評價,有望增加中標省份數量,進一步擠占競爭對手市場份額,從而實現弱者逆襲。
勝出的優質國產仿製藥將加速進口替代。其中,糖尿病、心血管疾病、腫瘤、呼吸係統疾病、乙肝等領域因市場規模巨大且目前市場大多被原研藥占據,將成為仿製藥一致性評價後首先受到衝擊的領域。筆者選取瑞舒伐他汀為本類別的代表品種。
他汀類是治療高膽固醇血症的首選藥物,瑞舒伐他汀鈣對肝髒具有高選擇性,降脂效果明顯,同時對中樞神經的副作用較其他他汀顯著減小,被譽為“超級他汀”。據IMS數據統計,2016年全國瑞舒伐他汀市場規模約28億元,阿斯利康市場份額不斷在萎縮,2016年占比56%,魯南貝特占比16%、京新藥業占比12%、正大天晴占比13%。

一致性評價進展方麵,京新藥業仿製藥一致性評價申請已於2017年7月5日獲得CDE受理,正大天晴於2017年8月24日獲得CDE受理。京新藥業有望在2018年初率先通過一致性評價,帶來新一輪增長。
從企業進展來看,京新藥業是目前一致性評價進展最快、CDE受理數量最多的企業。目前,該公司已經有3個品種獲得CDE的受理審評,分別為瑞舒伐他汀、左乙拉西坦、鹽酸舍曲林。隨著行業標準提升,市場格局有望重塑,低質量品種退出市場。另一方麵,國產高質量仿製藥與原研品種的待遇將快速拉近,優質國產仿製藥廠商將獲得重新瓜分市場份額的機會。第一批品種預計將在明年初落地。目前,該公司的瑞舒伐他汀、左乙拉西坦、鹽酸舍曲林均是國內一致性評價進展最快的品種,且有望成為CFDA首批審批通過一致性評價的品種,未來空間巨大。
隨著一致性評價的不斷推進,醫藥行業正迎來BE試驗高峰。應密切關注一致性評價政策帶來的市場競爭格局變化,把握未來大品種。未來,應對大多數的存量品種積極進行品種梳理、開展藥學研究、搶占BE資源。此外,還當關注工業基礎良好、國際化能力強的企業品種,這些品種可借助優先審評,以及國外上市轉國內申報審核後視同通過一致性評價的政策鼓勵,加速國內上市。
 相關新聞
相關新聞