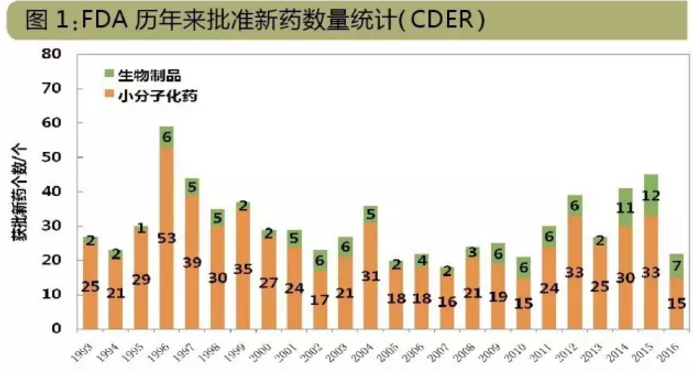
2016年,FDA下屬CDER共批準了22個新分子實體,包括:15個NDA、7個BLA。這個數字為2008年來新低,數字背後是小分子新藥銳減,生物製品則熱度不減。CBER則批準了4個新藥(新分子實體),包括2個凝血因子Ⅷ藥物Kovaltry和Afstyla、凝血因子Ⅸ藥物Idelvion和口服霍亂疫苗Vaxchora。
22個新分子實體(CDER)
2016年,FDA下屬CDER共批準了22個新分子實體,包括:15個NDA、7個BLA。這個數字為2008年來新低,數字背後是小分子新藥銳減,生物製品則熱度不減。CBER則批準了4個新藥(新分子實體),包括2個凝血因子Ⅷ藥物Kovaltry和Afstyla、凝血因子Ⅸ藥物Idelvion和口服霍亂疫苗Vaxchora。
盡管數量不多,但2016年獲批的新藥質量頗高:包括首個真正意義上的蛋白相互作用抑製劑(PPI)Venclexta、首個PD-L1抗體Tecentriq等。抗體藥物的表現更是讓人眼前一亮,包括抗菌抗體(3個)、哮喘抗體等,適應症更加廣泛,再次體現了抗體藥物的巨大潛在應用價值。
企業方麵,羅氏、默沙東、禮來、百健各有2個新藥獲批,艾伯維、賽諾菲、吉利德、梯瓦等巨頭各有1個新藥獲批,還有不少中小藥企亦有斬獲。
抗感染、抗腫瘤、神經係仍是熱點
從治療領域來看,2016年FDA批準新藥包括:
4個抗腫瘤藥物:CLL藥物Venclexta、膀胱癌/肺癌藥物Tecentriq和軟組織肉瘤藥物Lartruvo;
4個抗感染藥物:抗丙肝藥物Zepatier、Epclusa,抗炭疽熱藥物Anthim 和抗艱難梭菌感染藥物Zinplava;
3個神經係統藥物:抗癲癇藥物Briviact、帕金森精神病藥物Nuplazid和多發性硬化症藥物Zinbryta;
此外,免疫學實際上有2個藥物:銀屑病藥物Taltz和哮喘藥物Cinqair(作用機製為免疫調節,歸為呼吸係統藥物)。
新發放3張優先審評券
從2007年設立優先審評券製度以來,至2016年底,FDA共發放12張優先審評券,其中有3張是在2016年發出。PaxVax的霍亂疫苗Vaxchora在2016年6月10日獲批,獲得FDA發放的第10張優先審評券;Sarepta的杜氏肌營養不良症藥物Exondys 51於2016年9月19日獲批,獲得FDA發放的第11張優先審評券;百健和Ionis聯合開發的脊髓性肌肉萎縮症藥物Spinraza於2016年12月23日獲批,獲得FDA發放的第12張優先審評券。如果沒有國會通過立法延遲,兒科優先審評券將於2016年12月底截止,Spinraza算是成功搭上了兒科優先審評券的末班車。
隨著新藥研發競爭日益激烈,一紙優先審評券的價格可謂水漲船高。United在2015年轉讓給艾伯維的優先審評券達到了驚人的3.45億美元的價格。優先審評券設立的本意是為了促進熱帶病藥物的研發,後來在2012年增加了兒科罕見病。從實際情況來看,兒科優先券發放數量(8張)遠大於熱帶病(4張)。從市場角度看,熱帶病多在不發達地區常見,這也是熱帶病藥物研發更不活躍的主要原因。當然,優先審評券對於該類藥物的研發仍有著明顯的促進效果。
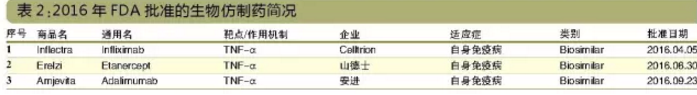
3個生物類似藥獲批
生物類似藥並非新藥,但2016年是具有裏程碑意義的一年,FDA共批準了3個抗體類似藥,是整個抗體藥物領域轉折點意義的一年。
2016年,FDA共批準了3個生物類似藥:Celltrion的Inflectra(參照藥為Remicade)、山德士的Erelzi(參照藥為Enbrel)和安進的Amjevita(參照藥為Humira)。
(點擊圖片可放大)
FDA在生物類似藥的監管方麵起步較晚,但近兩年進展迅速,畢竟這是全球最大的藥物市場。2016年,FDA接連批準了3個生物類似藥,在這3個案例中,也給更多布局生物類似藥研發的企業許多可供借鑒的經驗。從理化相似性評估策略、製劑專利規避、臨床適應症選擇/適應症拓展策略、知識產權糾紛等方麵,都給後來者提供了更多參考。
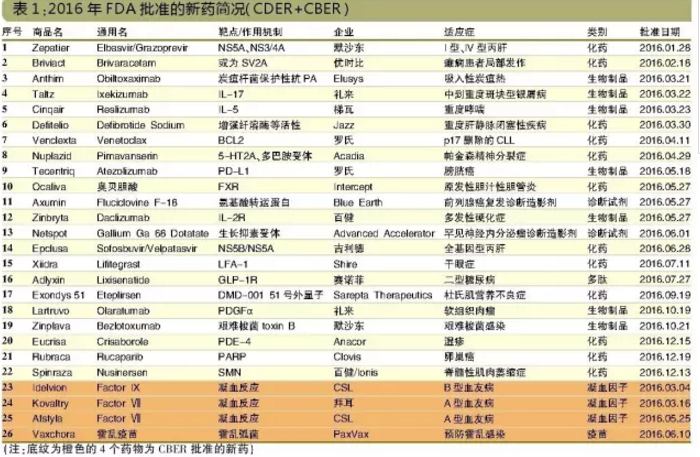
26個新藥點兵(CDER+CBER)>>>
Zepatier
Zepatier是一種口服丙肝藥組合,靶向NS5A,和NS3/4A。適應症為基因1、4型丙肝,2016年前三個季度銷售額分別為5000萬、1.12億、1.64億美元。目前丙肝領域最暢銷藥物依次為:Harvoni、Sovaldi、Epclusa、Viekira Pak、Daklinza、Zepatier。
Briviact
左乙拉西坦曾是最暢銷的抗癲癇藥物,布瓦西坦(Briviact)與左乙拉西坦結構相似,SV2A結合力增強10倍,為新一代抗癲癇藥物,其生物利用度更高、達峰時間段,市場前景看好。
Anthim
Anthim是2016年首個獲批的抗體藥,靶點為炭疽杆菌的保護性抗原PA。由於適應症為炭疽熱,沒有進行人體藥效學試驗,但進行了320名健康誌願者的安全性試驗,證實安全性良好。
Taltz
Taltz是一種靶向IL-17A的單克隆抗體藥物,為同類藥物的second-in-class,該類藥物中首個獲批的是諾華的Cosentyx。
IL-17抗體被證實是療效明顯勝過Enbrel的自身免疫病藥物,2016年Cosentyx銷售額將突破億美元,Taltz上市前兩個季度銷售額分別為1900萬美元、3300萬美元。
Cinqair
近年來炎症反應在哮喘適應症中的機理研究逐步深入,催生了很多相應靶點抗體藥物的開發。Cinqair是FDA批準的第二個IL-5抗體,第一個為GSK開發的Nucala,後者於2015年11月獲批。
Defitelio
Defitelio是從豬小腸提取的寡核苷酸混合物,治療費用為4.7萬美元/人年。由於製備工藝的專利僅保護到2017年,爵士製藥申請了分析方法專利將保護期延至2032年。2015年,Defitelio在歐洲市場的銷售額為7000萬美元,隨著美國市場的進入,其銷售額在2016年前三季度達到8000萬美元,成為爵士製藥旗下第三暢銷藥物。
Venclexta
Venclexta的獲批對於新藥研發具有裏程碑意義,因為其突破了傳統藥物化學的限製,是第一個真正意義上的蛋白相互作用(PPI)抑製劑。Venclexta是一種每日一次的口服藥物,適用於采用FDA批準的一款伴隨診斷試劑盒Vysis CLL FISH探針試劑盒確認為存在17p刪除突變的CLL患者。
Nuplazid
Nuplazid是一種血清素受體反相激動劑,靶向5-HT2A受體,降低其活性,從而減少中樞神經係統的興奮程度。Nuplazid也是首個獲批用於治療出現幻覺/妄想等精神疾病的帕金森症藥物。
Tecentriq
Tecentriq是首個獲批的PD-L1抗體藥物,這也是30年來針對轉移尿路上皮癌的首個新藥。10月18日,FDA批準Tecentriq用於轉移性非小細胞肺癌。至此,形成PD-1/PD-L1三足鼎立的局麵。
Zinbryta
Zinbryta的活性成分為CD25抗體Daclizumab(達利珠單抗),用於多發性硬化症。實際上,達利珠單抗並非一種新分子實體,1997年羅氏開發了達利珠單抗,用於器官移植的免疫抑製,以商品名Zenapax上市,由於銷售表現不佳在2009年退市。百健在前者基礎上針對新的適應症進行了有目的的工藝創新,得到了糖基化修飾一致性更好、ADCC活性更低的高產達利珠單抗。
Ocaliva
Ocaliva(奧貝膽酸)在熊脫氧膽酸基礎上優化開發的me-better藥物,用於治療原發性膽汁性膽管炎(PBC)。與熊脫氧膽酸相比,奧貝膽酸增加了FXR結合活性,因而藥物活性更高、劑量更低。
Axumin
Axumin為正電子發射計算機斷層顯像(PET)試劑,用於診斷患者前列腺特異性抗原(PSA)的升高,從而檢測前列腺複發的可能性。
Netspot
Netspot是一種镓68-donatate放射性注射劑,用於PET掃描城鄉。FDA批準Netspot用於檢測一種罕見神經內分泌腫瘤。
Epclusa
Epclusa是一種治療丙肝複方製劑,活性成分包括靶向NS5B和NS5A。Epclusa可用於全部6種基因型丙肝患者,市場潛力巨大,上市第二季度銷售額即達到6.4億美元,成為僅次於Harvoni、Sovaldi的第三暢銷丙肝藥物。預計後續很快超過Sovaldi。
Xiidra
Xiidra用於治療幹眼症,是一種特異性結合LFA-3的小分子,阻斷LFA-3與ICAM-1的相互作用,而ICAM-1常在幹眼症患者過度表達。Xiidra是13年來FDA批準的首個幹眼症藥物。目前市場上最主要的幹眼症藥物為愛兒健的Restasis(環孢黴素),2015年銷售額為13億美元。與Restasis相比,Xiidra起效更快(2周vs 6周),Shire也為Xiidra定下了與Restasis相當的價格,都在5000美元/年左右。預計Xiidra將對Restasis帶來強大衝擊。
Adlyxin
Adlyxin的成分為GLP-1受體激動劑利西拉來,該藥物在歐洲以商品名Lyxumia上市。利西拉給藥頻率為一天一次,在強者如林的GLP-1受體激動劑市場很難有所作為。利拉魯肽一直統治市場,一周一次bydureon緊隨其後,近兩年上市的一周一次度拉魯肽又強勢進場,利西拉來並無任何明顯優勢。賽諾菲的布局重點在於推動利西拉來/甘精胰島素複方製劑的開發,其直接競爭對手為諾和諾德的利拉魯肽/德穀胰島素複方製劑。
Exondys 51
Exondys51是FDA批準的首個杜氏肌營養不良症藥物,其獲批是近年來FDA批準藥物中最具爭議的。一方麵Exondys51的有效性非常模糊,另一方麵谘詢委員會明確拒絕,在這樣的情況下FDA做出了批準決定,超出市場預料。
Lartruvo
Lartruvo靶向PDGFα,與多柔比星聯合治療成人軟組織肉瘤(STS),這是40年來首個療效顯著優於必行單獨用藥的聯合治療方案。
Zinplava
Zinplava靶向艱難梭菌的Toxin B,用於治療艱難梭菌感染。艱難梭菌感染往往病情嚴重,複發率高,是後抗生素時代十分棘手的問題,感染率在過去20年間急速上升。
Eucrisa
Eucrisa為一種非甾類PDE-4抑製劑,用於治療濕疹。Eucrisa由Anacor開發,今年6月,輝瑞耗資52億美元收購Anacor。輝瑞憑借Enbrel、Xeljanz兩大免疫/炎症產品掌握了大量該領域資源,有望在特異性皮炎(濕疹)領域為Eucrisa迅速擴大市場份額。
Rubraca
Rubraca為一種PARP抑製劑,由Clovis開發,成為繼Lynparza後第2個上市的PARP抑製劑,適應症為卵巢癌。Rubraca最初由輝瑞開發,後來由於賽諾菲的IniparibⅢ期失敗,導致PARP的開發蒙上陰影。其他大藥企紛紛脫手,Clovis由此獲得Rucaparib。
Spinraza
Spinraza(Nusinersen)為一種反義寡核苷酸藥物,由百健和Ionis聯合開發,用於治療骨髓性肌肉萎縮症。同時,百健獲得了FDA授予的第12張兒科優先審評券。由於兩次延期的兒科優先審評券於2016年12月31日到期,百健這次加速批準可謂是占了大便宜。
Idelvion
Idelvion由CSL開發,是第一款白蛋白融合型凝血因子Ⅸ,半衰期延長5倍,與百健上市的首個長效凝血因子Ⅸ(半衰期延長3倍)相比半衰期更長,給藥頻率可達到一周一次,可控後可達到每兩周給藥一次。
Kovaltry
Kovaltry是一種新的全長的、未經修飾的凝血因子Ⅷ產品,采用BHK細胞表達,糖基化修飾與內源Ⅷ因子類似,α-Gal和NGNA糖型的比例控製在1%以下。Kovaltry與Kogenate FS結構一致,主要是經過了一係列的生產工藝優化。
Afstyla
Afstyla是首個單鏈結構的Ⅷ因子,其半衰期與天然Ⅷ因子類似,但穩定性明顯提高,同時與vWF親和力增強。Afstyla利用CHO細胞表達,輕重鏈連接區有一個新的N-糖基化位點,其他糖基化修飾與內源Ⅷ因子類似。
Vaxchora
Vaxchora由百慕大PaxVax Bermuda公司開發,獲得FDA授予的快車道地位和優先審查資格,並獲得一張熱帶病優先審查券。
Vaxchora是一種活的弱毒疫苗,通過單次口服免疫,大約為3盎司液體,旅行者需在前往霍亂受災國家和地區前至少10天服用。Vaxchora的有效性在一項隨機、安慰劑對照、人體研究中得到證實。數據顯示,在Vaxchora免疫10天的受試者中,Vaxchora預防霍亂的有效率達到了90%;在Vaxchora免疫3個月的受試者中,Vaxchora預防霍亂的有效率達80%。














 相關新聞
相關新聞