
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




11月11日,為落實CFDA《關於仿製藥質量和療效一致性評價工作有關事項的公告》(2017年第100號)的“對符合《人體生物等效性試驗豁免指導原則》的品種,以及不適合開展人體內研究的品種,國家食品藥品監督管理總局區別情況,分批公布具體品種目錄”的要求,仿製藥質量與療效一致性評價辦公室組織人員對289基藥目錄內品種進行了梳理和調研,並經CFDA仿製藥質量和療效一致性評價專家委員會審議,擬定了首批擬推薦豁免或簡化生物等效性試驗(BE)的品種名單,合計涉及57個產品。
根據《總局關於落實〈國務院辦公廳關於開展仿製藥質量和療效一致性評價的意見〉有關事項的公告》(2016年第106號),凡2007年10月1日前批準上市的列入國家基本藥物目錄(2012年版)中的化學藥品仿製藥口服固體製劑,原則上應在2018年底前完成一致性評價的品種289個,按同年總局公布的《關於2018年底前須仿製藥質量和療效完成一致性評價品種批準文號信息》統計結果,合計17,740個批文將要在2018年年底完成一致性評價。
自2016年4月總局公開征求《人體生物等效性試驗豁免指導原則》的意見到同年5月正式稿發布起,業界一直在期待《可豁免或簡化人體生物等效性試驗(BE)品種目錄》的發布。
2017年11月首批目錄終於發布征求意見稿且至12月11日結束意見征求,距離2018年年底的時間僅一年有餘。本文主要對可豁免或簡化的已上市品種批文情況進行分析。
可豁免或簡化生物等效性試驗(BE)的品種名單,將品種分為“豁免BE品種”和“簡化BE品種”兩類。
可豁免BE品種共44個,涉及批文4167個。其中,擬處理辦法“采用藥學方法評價一致性,可豁免BE”的有20個;“采用藥學方法評價一致性,企業自證BCS(生物藥劑學分類係統)1或3類,根據《人體生物等效性豁免指導原則》提交溶解度、滲透性、溶出度等相關研究資料”的有20個;“采用藥學方法評價一致性,采用比較PK方法評價安全性”的有4個。
“采用藥學方法評價一致性,可豁免BE”的20個品種中,異煙肼片是在2018年年底前需要完成一致性評價批文數最多的產品,維生素B6片和維生素B2片緊隨其後。
批文數在5個以內的產品有磷酸伯氨喹片、聚乙二醇4000散、氯化鉀顆粒、琥珀酸亞鐵片、環磷酰胺片和左氧氟沙星片。按總局《關於企業開展289目錄內仿製藥質量和療效一致性評價基本情況信息》,左氧氟沙星片暫無企業啟動一致性評價。
先聲藥業有限公司蒙脫石散的一致性評價申請已被受理,是20個豁免BE品種中的首個申報品種。
表1 “采用藥學方法評價一致性,可豁免BE”品種情況
(數據來源:鹹達數據V3.2)
按照《人體生物等效性試驗豁免指導原則》,藥品被分為四類,分別為BCS1類“高溶解性、高滲透性”,BCS2類“低溶解性、高滲透性”,BCS3類“高溶解性、低滲透性”和BCS4類“低溶解性、低滲透性”。其中BCS1類和BCS3類的藥物,隻要處方中的其他輔料成分不顯著影響API的吸收,則不必證明該藥物在體內生物利用度和生物等效的可能性,即生物等效性豁免。
BCS1類的藥物要想獲得生物等效性豁免,需要證明藥物具有高溶解性和高滲透性,仿製藥製劑和參比製劑均為快速溶出,並且製劑中不含有影響主藥成分吸收速率和吸收程度的任何輔料。BCS3類的藥物則需要證明藥物具有高溶解性,仿製製劑和參比製劑均具有非常快速的溶出,兩者處方完全相同,各組成用量相似,當放大生產和上市後變更時,製劑處方也應完全相同。
“采用藥學方法評價一致性,企業自證BCS1或3類,根據《人體生物等效性豁免指導原則》提交溶解度、滲透性、溶出度等相關研究資料”的品種,共涉及1908個批文數。其中,甲硝唑片批文數最多,鹽酸雷尼替丁膠囊和對乙酰氨基酚片批文數緊隨其後。暫無企業啟動一致性評價的產品為對乙酰氨基酚顆粒。
在《人體生物等效性試驗豁免指導原則》的附錄A中,曾公布一批用於說明滲透性試驗適用性的推薦藥物,其中阿替洛爾、雷尼替丁就屬於滲透性類別“中滲透性(fa=50%—84%)”,兩者在世界衛生組織發布的BCS分類(2005年)中皆為3類。
按企業開展結果,豁免BE品種預計925個批文若啟動,則預計企業將要花費的研發費用高達28億元。
表2 “采用藥學方法評價一致性,企業自證BCS1或3類”豁免 BE品種情況
(數據來源:鹹達數據V3.2)
“采用藥學方法評價一致性,采用比較PK方法評價安全性”主要涉及枸櫞酸鉍鉀和膠體果膠鉍兩個通用名,對應批文總數為101個。
表3 “采用藥學方法評價一致性,采用比較PK方法評價安全性”豁免BE品種情況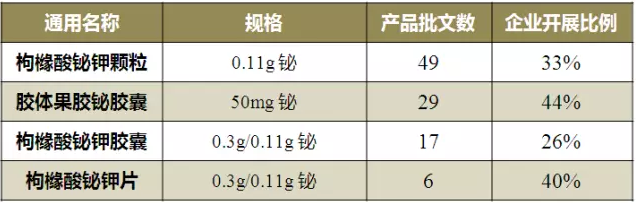
(數據來源:鹹達數據V3.2)
“簡化BE品種”分為“推薦僅餐後研究”和“推薦僅空腹研究”兩種擬處理辦法。
“推薦僅餐後研究”僅替硝唑片0.5g規格,對應批文28個,企業開展比例65%。鹹達數據V3.2發現,目前僅華潤雙鶴利民藥業(濟南)開展餐後研究。
“推薦僅空腹研究”中,複方磺胺甲噁唑片批文數最多,其次是利福平膠囊,卡托普利片排名第三。卡托普利片已有石藥集團歐意藥業申報一致性評價,同期啟動空腹研究的有常州製藥廠、山東新華製藥和山東羅欣藥業,但暫未申報一致性評價。
按企業開展結果,若簡化BE品種408個批文啟動,則研發費用預計25億元。
表4 簡化 BE品種“推薦僅空腹研究”情況
(數據來源:鹹達數據V3.2)
豁免BE或簡化BE是基於BSC分類原則作出的生物等效豁免。首批擬推薦豁免或簡化BE品種名單的公布,並不代表一致性評價的標準放寬,反而體現了我國一致性評價的標準正與國際化掛鉤,對治療窗很寬的低風險品種進行合理地豁免或簡化。實際上,首批名單中已受理一致性評價申請的企業早就按照BSC分類原則申請豁免和簡化。
若以所有批文都啟動臨床來計算,豁免BE品種對應4167個批文,若以500萬元臨床費用統計,預計對應豁免臨床費用為208.35億元。簡化BE品種對應2020個批文,若以300萬元臨床費用統計,對應簡化的臨床費用為60.6億元。兩者合計有269億元的紅利。
按企業開展結果,若豁免BE品種預計925個批文啟動,則預計企業將要花費的研發費用高達28億元;若簡化BE品種408個批文啟動,則研發費用預計25億元。本次57個品種名單涉及53億元的研發費用,預計豁免或簡化的研發費用59億元。
市場潛力較大且批文數較少的品種豁免BE或簡化BE後,原定未打算開展的已上市批文企業或未有批文的企業可能會加入競爭。
其餘未進入首批名單的231品種對應的企業也可向CFDA提出豁免申請並說明理由,CFDA經論證後,決定是否同意豁免。
 相關新聞
相關新聞