
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




作為近年來較重要的供給側改革政策,一致性評價工作的有效推進,將在各方參與主體,包括原研/仿製企業、藥品審評審批及監管相關部門、藥品使用者之間產生正和博弈或至少是零和博弈,具有深遠的社會意義。
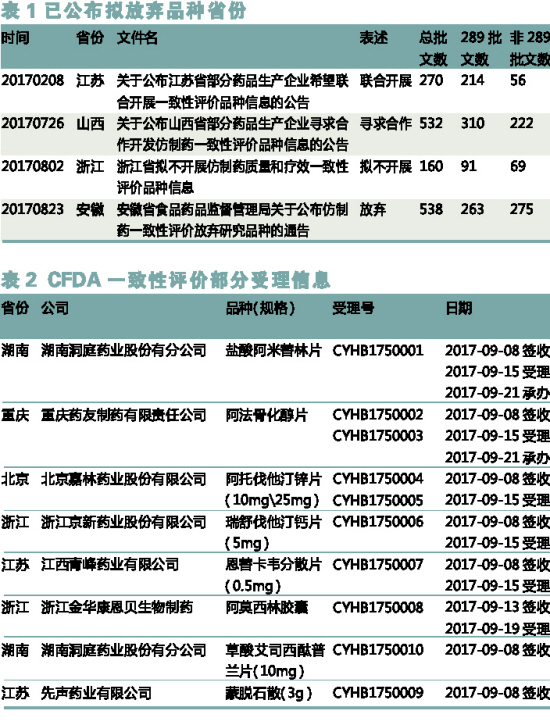
目前政策要求仿製藥一致性評價品種為化學藥品新注冊分類實施之前批準上市的仿製藥(包括國產仿製藥、進口仿製藥、原研藥品地產化)。強製實施品種為2007年9月1日之前批準的基藥目錄裏的化學仿製口服固體製劑,共289個品種,需在2018年底完成;其餘品種自首家通過一致性評價之後,其他企業同品種原則上3年內完成,未完成不予以注冊。實施關鍵環節包括“參比製劑備案(選擇國家目錄)-處方工藝二次開發(藥學研究)-BE備案-BE試驗-現場考核(省局)-藥檢所複核-一致性評價申報-CFDA審批”,目前來看,完成一致性評價工作整個流程大約需要20~28個月。
 相關新聞
相關新聞