
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




根據國際製藥企業與協會聯合會(IFPMA)報告,2014年全球醫藥研發投入約為1416億美元,醫藥產業在所有產業中研發投入始終名列前茅,即便在經濟動蕩和金融危機時期亦是如此。與其它高技術領域相比,醫藥產業R&D年投入是航天與國防產業的5倍,化工業的4.5倍,軟件和計算機服務工業的2.5倍。
隨著藥物創新難度不斷提高,過去的15年裏,美國製藥企業R&D投入持續增長,美、歐、日R&D投入強度分別為16.3%、13.3%和14.6%。
其中,抗腫瘤藥物是目前在研藥物最大的治療領域。根據全球商業智庫(GBI)的研究報告,2016年第一季度,前三大治療領域在研藥物數量占整個醫藥工業研發管線在研藥物總數的68%,其中抗腫瘤藥物是最大的治療領域,在研藥物數量近7000個,約為第二、第三大治療領域在研藥物數量之和,位列第二、三位的治療領域分別為傳染性疾病及中樞神經係統疾病(在研藥物數量均超過3000個)。
在美國,2015年FDA批準的新藥數量創新高,包括45個新分子實體(NMEs)和新生物製品許可申請(BLAs),2014年和2013年這一數字分別為41個和27個。
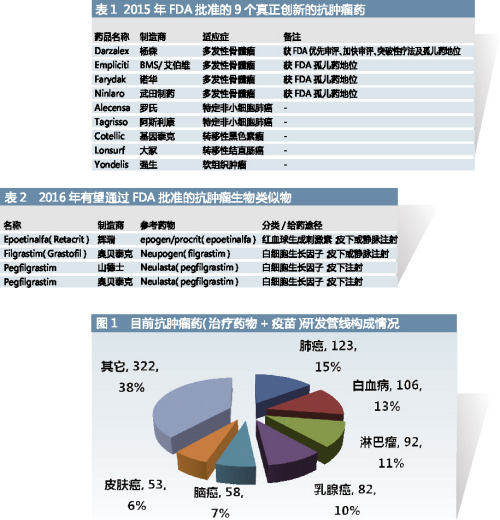
作為目前最大的治療領域,過去的10年中,FDA批準的抗腫瘤新藥數量空前,僅2015年就有19個,其中被認為屬於真正創新的藥物共9個。其中包括4個用於治療多發性骨髓瘤的藥物,此病5年生存率小於50%,目前不可治愈且複發風險高,大多數治療多發性骨髓瘤的藥物在重複給藥後失去療效,因此通常需要與其它藥物聯合使用。4種藥物均具有孤兒藥地位,其中Darzalex獲得了FDA優先加快審評,被FDA歸為突破性療法。此外,還有2個治療特定非小細胞肺癌的藥物、1個治療轉移性黑色素瘤的藥物、1個轉移性結直腸癌治療藥物和1個軟組織腫瘤治療藥物。
在抗腫瘤領域,2016年上半年FDA共批準了4個創新藥和13個新的適應症,其中有一些是首創藥。4個創新藥包括:4月11日批準的第一個治療17p染色體缺失導致的慢性淋巴細胞性白血病的BCL-2抑製劑Venclexta(艾伯維/基因泰克),獲得FDA加快審批、突破性療法授權、優先審評、孤兒藥地位;4月25日批準的治療進行性腎細胞癌的酪氨酸激酶抑製劑Cabometyx(Exelixis),獲得FDA突破性療法授權、快速通道審評和優先審評;5月18日批準的第一個治療轉移性膀胱移行細胞癌的PD-1配體1抑製劑單克隆抗體藥物Tecentriq(基因泰克),獲得FDA突破性療法授權、加快審批、優先審評,是該治療領域的首創藥物;以及6月1日批準的用於定位生長抑素受體陽性表達神經內分泌瘤的放射性診斷試劑Netspot(ADVANCED ACCELERATOR APPLICATIONS USA INC),獲得FDA優先審評。
這些藥物凸顯近年來抗腫瘤藥研發管線的創新趨勢,生物技術越來越多地應用於抗腫瘤藥物研發過程中,如免疫療法、單克隆抗體、過繼性細胞療法及疫苗等,2015年及2016年以來上市的首創藥物以及眾多針對特定腫瘤的第一個治療藥物也是最好的證明。
突破性療法和孤兒藥仍是2016年腫瘤新藥審評的兩大關鍵詞,反映FDA在鼓勵滿足特定患者人群治療需求的潛在救命藥研發上所作出的努力。
其它處在研發末期階段的包括治療膀胱癌、腎細胞癌以及其它腎癌、黑色素瘤、胰腺癌、軟組織癌以及骨髓纖維變性等藥品。近年來,盡管黑色素瘤等癌症已經批準了很多治療藥物,但膀胱癌及腦癌等卻很少或沒有相應的藥物批準。同樣,這些藥物中很多也獲得了突破性療法或孤兒藥授權,獲得FDA加速審批。
事實上,FDA正通過多種途徑加快創新藥物的審評審批。除了突破性療法和孤兒藥,還有Fast Track途徑、優先審評、加速審批以及幫助企業加速研發和提高藥物可獲得性。
以2015年為例,FDA批準的新藥中,31%獲得CDER的Fask Track授權,22%獲得突破性療法授權,53%獲得優先審評,13%獲得加快審評。整體來看,60%的新藥接受了FDA多種加快審評途徑中的一種或幾種,在新藥審評的過程中,FDA對於創新始終給予足夠的青睞。
研發線特點:適應症分布與疾病譜一致
根據GBI研究報告,2016年第一季度,在研抗腫瘤藥物以乳腺癌、肺癌及結直腸癌產品為主導,上述領域的研發管線增長均超過15%。除中樞神經係統疾病和免疫療法產品在研數量稍有降低之外,其餘治療領域在研藥物數量增長都超過5%。女性健康產品盡管是最小的治療領域,卻是增長最快的領域,研發線增長55%。
一季度主要的適應症研發線自2015年已開始增長。但是,絕大部分在研產品處在初期研發階段,也意味著其安全性和有效性尚難確認。盡管如此,整個研發線的規模增長還是預示著,在不遠的將來將會有穩定的增量創新和突破性創新產品流入。
目前,抗腫瘤藥研發線尚未顯現任何放緩的信號。根據IMS的新近報告,抗腫瘤藥研發線在過去的10年間增長了63%。
美國藥物研究與製藥商協會(PhRMA)披露,目前有836個腫瘤治療藥品和疫苗在研發的不同階段,有些處於臨床試驗階段,有些在等待FDA的審評。此外,抗癌藥研發線中約80%是潛在的首創藥,73%可歸為對腫瘤特定基因具有靶向作用的個性化治療藥物。
腫瘤藥物研發與疾病譜相一致,特別是與嚴重威脅人類健康疾病的治療需求相一致。
其中,肺癌用藥的研發正在並將持續處於研發管線主導地位,2016年乳腺癌、白血病、肺癌以及卵巢癌等癌症在研發管線中都將有3個以上的新藥上市或進入研發的末期階段。這些藥物中的大部分已經收到了FDA突破性療法授權(breakthrough therapy designation)、孤兒藥授權(orphan drug designation)或二者兼有,而且很多藥物獲得FDA多種形式的加速審評。
生物類似藥是腫瘤研發線中的最新趨勢,以去年FDA批準的Zarxio為開端。Zarxio是美國批準的第一個生物類似藥,打開了一類新型生物製品的大門,可能會有助於控製生物製品不斷上升的成本。
可以預期,2016年FDA待批準的生物類似藥的數量將上升。目前已有4個抗腫瘤生物類似藥的生產者提交了BLA申請,其中的3個FDA已受理。
此外,口服抗腫瘤藥物也是一個增長點,因其較注射給藥途徑更為方便,在研藥物比5年前更為常見,且口服藥物占據抗腫瘤藥總成本的比重也較前更大。
新的抗癌藥物為醫生和患者提供了更多治療選擇和新作用機製,使患者的生命延長數月或數年。一些藥物通過調動人體自身的免疫係統來對抗癌症;還有一些幫助患者將開始化療的時間延後,如日本安斯泰來製藥生產的前列腺癌新藥Xtandi(恩雜魯胺)。
這些治療藥物雖對患者的治療起到積極作用但價格昂貴,平均每次處方花費超過8000美元。2015年新批準的19個抗腫瘤藥使該治療領域的花費增長了23.7%。花費最高的格列衛和Revlimid(來那度胺)兩種藥物占據抗腫瘤藥物市場份額的22%。2016年2月批準上市的格列衛的第一個仿製藥將會使費用有所下降,此外,前列腺癌藥物Zytiga(阿比特龍)的仿製藥也預計將在2018年10月上市。
在抗腫瘤藥研發領域,創新勢頭強勁,令人振奮的新藥自2014年初至2015年上半年加快湧入市場,目前有更多藥物處在研發的不同階段。但是,抗腫瘤藥物的治療成本一直是患者和支付方麵臨的重要障礙。近年來,隨著抗腫瘤新藥的不斷湧現,全球抗腫瘤藥物治療費用也在不斷增長,IMS數據顯示,2014年治療費用已達到1000億美元大關。分析原因,數量眾多的新靶向治療藥物的問世提高了支付方對新藥同已有藥物增量效益價值比較的審查,品牌抗腫瘤藥平均每月的治療成本為10000美元,而十年前平均為5000美元。靶向治療藥物目前占抗腫瘤藥總費用的50%,並且在過去的五年中以14.6%的複合增長率增長。
根據IMS報告,2015年全球腫瘤藥物及輔助藥物治療成本上升了11.5%,目前已達到1070億美元,預計到2020年全球腫瘤藥物治療成本將超過1500億美元。
這種趨勢在一定程度上反映了免疫療法及靶向治療的高昂治療成本,而這些藥物未來也將繼續作為研發管線中的主導產品。
未滿足的治療需求是藥物創新的直接驅動,而藥品審評政策對藥物創新有正向激勵作用,在全球藥物研發投入不斷增加的大背景下,腫瘤等重點研發領域依然受到創新藥物研發企業的青睞,值得我國創新藥物研發公司關注。而美國FDA對創新藥物激勵經驗則值得我國藥品審評機構借鑒和參考。
 相關新聞
相關新聞