2016中美歐藥物審批最新報告第一季
3月GEN公司公布了2015年上市新藥銷售TOP15榜單,從榜單來看,雖沒有吉利德2013及2014年分別獲批的丙肝藥Sovaldi、Harvoni的銷售業績來得傳奇,但也有2月獲批的輝瑞治療乳腺癌藥物Ibrance 以年銷售7.23億美元的業績接近撞線重磅藥的入門線。
追蹤近三年的新藥王,故事新奇度令人瞠目。2013年的Sovaldi,2014年銷售飆升至102.8億美元,2015年銷售直落至52.8億美元,猶如過山車般感覺;2014年的Harvoni,由2014年銷售的21.3億美元直接上竄至2015年的138.6億美元,它2016年的銷售業績毫無疑問成為萬眾關注的焦點;2015年的Ibrance,應不會有如此令人心跳的感覺,但今年銷售輕鬆打榜重磅藥榜單已是大勢所趨。那麽即將來臨的2016年第一季,出現在大眾麵前的新藥,給人心跳的感覺是萬馬奔騰還是死水微瀾呢。
美國:
2016年第一季,FDA公布了848條審批信息。其中一月份258條審批信息,包括NDA(新藥申請)193條、BLA(生物製品申請)8條、ANDA(簡略新藥申請)57條;這其中包含49條批準信息;另外還有17條臨時性批準信息,其餘為標簽變更、補充臨床數據等相關信息。二月份共計279條審批信息,包括NDA 215條、BLA 5條、ANDA 59條;這其中包含59條批準信息,9條臨時性批準信息,其餘為其他相關信息。三月份共計311條審批信息,包括NDA 226條、BLA 12條、ANDA 73條;這其中包含67條批準信息,13條臨時性批準信息,其餘為其他相關信息。總體來看第一季共批準2個新分子實體和3個生物製品。
表1 2016年第一季FDA批準的新分子實體

表2 2016年第一季FDA批準的生物製品

2月FDA一口氣批準優時比治療癲癇藥物BRIVIACT的片劑、注射液以及口服溶液三種劑型的多個規格。它是優時比重磅抗癲癇藥物開浦蘭(左乙拉西坦)專利陸續到期後,推出的一款新型的抗癲癇藥。開浦蘭是1999年獲批的新分子實體,2008年銷售達到峰值的12.66億歐元,在其美國排他性銷售2008年、歐洲2010年陸續到期後,銷售開始下滑,好在其日本市場排他性銷售要到2018年才到期,其2015年的銷售依然堅挺在7.37億歐元的水平。BRIVIACT與開浦蘭結構類似,臨床研究證實,與安慰劑組相比BRIVIACT每28天部分性發作頻率明顯減少。基於其良好的藥理學活性、臨床療效及安全性,BRIVIACT有望成為繼左乙拉西坦後又一重磅抗癲癇藥物。
3月Defitelio的獲批,標誌著美國首款治療嚴重肝靜脈阻塞的藥物得以上市,肝靜脈阻塞是一種罕見卻致命的疾病,通常見於那些接受過高劑量化療以及血液幹細胞移植的血癌患者。接受血液幹細胞移植的人群的2%會出現這類並發症,而其中80%都是致命的。但是該藥早在2013年就獲得歐盟的批準,時間先於美國一年半。
3月獲批的一款新的吸入性炭疽治療藥物Anthim,是一種單克隆抗體,旨在中和炭疽杆菌產生的毒素。炭疽是一種潛在的生物恐怖威脅,它的獲批標誌著美國反恐防恐的未雨綢繆。
歐盟:
歐盟2016年截止3月31日批準了22個藥物,其中1月獲批的由韓國生物製藥開發依那西普生物仿製藥Benepali特別引人注目,它是繼去年9月獲得韓國監管部門批準之後,首個歐盟批準的依那西普生物仿製藥,臨床用於中度至重度類風濕性關節炎、銀屑病關節炎、非放射性中軸性脊柱關節炎、銀屑病成人患者的治療。
優時比治療癲癇藥物BRIVIACT在歐盟的獲批則早於美國,它是1月獲得歐盟批準的新藥。
3月歐盟批準了2個孤兒藥上市,其中一個是治療罕見出血性疾病——遺傳性凝血因子X缺陷症的藥物Coagadex,而它早在2015年10月就獲得FDA的批準。另一個是治療治療伴隨或不伴隨猝倒發作嗜睡症的Wakix,早在去年11月CHMP就建議批準Bioprojet製藥的本品,3月31日終於獲批。
中國:
經過藥物注冊申請積壓以及藥物再評價等一係列事件後,國內今年一季度藥物批文數量屈指可數。從2月CFDA開始公布月度藥品批準上市情況來看,截止目前,國內第一季度共批準了44個藥品上市,其中一月2 個、二月15個、三月27個批文。
藥物注冊方麵,進口注冊的生物抗體類藥物等引起了筆者的關注。隨著抗體類藥物的持續發燒,欲進入中國市場的此類藥物日漸豪華。2月有申請臨床的Pembrolizumab、Nivolumab、Atezolizumab、Anetumab Ravtansine、美泊利單抗;3月有申請臨床的Idarucizumab、PDR001、Avelumab、Tremelimumab、Solanezumab。其中Pembrolizumab和Nivolumab於2014年獲FDA批準,美泊利單抗和Idarucizumab於2015年獲FDA批準。而Atezolizumab、Avelumab、Tremelimumab等還均處於臨床試驗階段,Atezolizumab和Avelumab等屬於近年來炙手可熱的PD-L1免疫療法,並分別獲得FDA授予的優先審查資格及突破性療法認定。
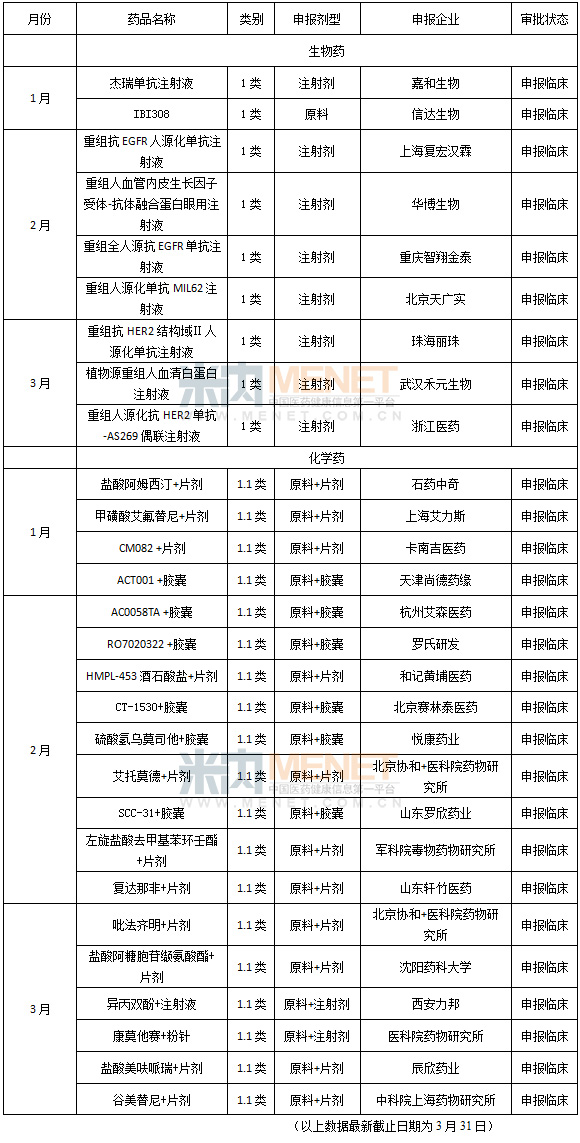
國內企業新藥注冊方麵,雖然去年屠呦呦獲諾貝爾獎引發中藥研發熱潮,但一季度沒有一類中藥新藥的申報信息。而化藥和生物藥的1類新藥基本都處於申請臨床階段,離上市時間尚遠。而處於申請生產狀態的藥物,不論中藥、化藥還是生物藥基本屬於仿製藥,隻有四川科倫藥業的碳酸氫鈉林格注射液屬於化藥3.2類新藥。
表3 2016年第一季國內一類新藥審批情況(化藥隻含1.1類,生物藥不含預防用製品)

分享到:

















 相關新聞
相關新聞