在腫瘤免疫治療領域,PD-1抑製劑自首次露麵以來就一直帶著光環,臨床試驗、審批階段都受到相關機構的加速批準待遇。自2014年全球首個該類藥物獲得批準以來,國外各企業高度聚焦,臨床試驗也是加緊進行。讓人欣慰的是,國內企業也毫不示弱,截至2016年2月底,已經有4家本土企業積極投入到這場激烈戰鬥中。
隨著精準醫療概念的提出,有關免疫治療與腫瘤基因突變關係的研究得到越來越多的關注。在衛計委重大新藥創製2015年重點研究方向中,提出研發重點要針對惡性腫瘤等重大疾病,並進一步聚焦為靶向及免疫抗腫瘤藥物,還提出了推薦的藥物靶點,包括PD1、PD-L1靶點,明確範圍無疑將使國內製藥企業研發目標更準確。
目前國外已上市的抗PD-1/PD-L1藥物是百時美施貴寶(BMS)的Opdivo(Nivolumab)和默沙東的Keytruda(Pembrolizumab),其他處於在研階段的藥物有Pidilizumab(CT-011,CureTech)、Avelumab(默克)、BMS-936559(MDX-1105,BMS)、Atezolizumab(MPDL3280A,羅氏)和MED14736(阿斯利康)。
查詢CDE數據發現,近兩年,在國內PD-1/PD-L1市場中也出現一批領先“玩家”,包括君實生物、恒瑞醫藥、百濟神州、嘉和生物等,泰州君實和江蘇恒瑞先後獲得了臨床試驗批件,目前沒有在中國上市者。
全球專利技術情況
從PD-1抗體專利技術布局來看,抗體專利申請量最多,其次是抗受體、抗腫瘤藥、DNA重組技術、受體表麵抗原等。
從權利人來看,專利最多的公司是日本小野製藥(ono pharmaceutical)和達納法伯癌症研究機構(dana-farber cancer institute)。
從PD-1抗體專利市場布局來看,美國是各大藥企最重要的市場,各申請人在美國共布局了156件專利,基本覆蓋全部技術類別;歐洲、日本和中國也是各大藥企競相追逐的市場;此外,奧地利、阿根廷、秘魯、波蘭等國均有專利布局。
國外研發進展上市藥物
●Opdivo(Nivolumab,納武單抗)
●2020年銷售額預計:88億美元
2014年7月,Opdivo(nivolumab)率先在日本獲批用於治療晚期黑色素瘤,成為全球首個批準上市的PD-1抑製劑。
Nivolumab由BMS和小野製藥共同開發。截至目前,Opdivo已經在46個國家獲批上市(不含中國)。Opdivo因療效顯著而4次臨床試驗提前結束,因此FDA隻用了4個工作日便批準其鱗狀非小細胞肺癌適應症,創審批速度新紀錄。
BMS的2015年年報顯示,Opdivo第四季度銷售增長至4.7億美元,全年貢獻了9.42億美元。
據EvaluatePharma預測,Opdivo(Nivolumab)將成為PD-1/PD-L1領域最成功的免疫療法,2020年銷售額將達到88億美元。
●Keytruda(Pembrolizumab,派姆單抗)
●2020年銷售額預計:55億美元
默沙東的Keytruda通過企業收購獲得。2014年,該藥的上市申請啟動,並獲得突破性治療藥物資格,於2014年9月4日獲FDA批準,比限期日提前50天,成為FDA批準的第一個PD-1抗體藥物。默沙東就該藥與輝瑞、安進及Incyte達成合作協議,將其與其他抗癌藥合用以擴大適應症範圍。
默沙東2015年年報顯示,Keytruda第四季度累計2.14億美元,全年銷售達5.66億美元。
據EvaluatePharma預測,Keytruda(pembrolizumab)2020年銷售額將達到55億美元。
其他在研藥物
●Atezolizumab 2015年8月,羅氏宣布,其開發的PD-L1藥物Atezolizumab(代號MPDL3280A)在一項治療非細小性細胞肺癌的Ⅱ期臨床研究中取得重大成功,公司將憑借這一結果向FDA尋求加速審批,以追上在前麵的Opdivo(BMS)和Keytruda(默沙東)。
●Avelumab 2015年11月,默克(Merck KGaA)和輝瑞合作開發的抗PD-L1免疫療法Avelumab被FDA授予治療既往已接受至少一種化療方案的轉移性Merkel細胞癌患者的突破性藥物資格。2015年9月和10月,FDA已授予Avelumab孤兒藥地位和快車道地位。目前,Avelumab的臨床開發項目涉及超過15種腫瘤類型。
●Durvalumab 阿斯利康的Durvalumab(代號MEDI4736)是一種PD-L1抑製劑,用於治療非小細胞肺癌的研究處於Ⅲ期臨床階段;對黑色素瘤的研究處於Ⅰ期臨床階段。對結直腸癌的研究處於Ⅱ期臨床階段。目前,其他競爭對手盡管已將結直腸癌列為研究的一部分,但尚未針對結直腸癌開展專門研究。因此,阿斯利康推進其PD-L1抑製劑項目MEDI-4736至結直腸癌,將開啟一個潛在的一鳴驚人的機會。
●Pidilizumab CureTech公司的Pidilizumab(代號CT-011)是針對PD-1的重組單克隆抗體,目前處於Ⅱ期臨床研究階段,擬適應症包括大B細胞淋巴瘤、膠質細胞瘤和多發性骨髓瘤。
臨床客觀緩解率
2015年8月,期刊《Current Opinion in Pharmacology》匯總了PD-1/PD-L1的部分品種及部分臨床,翻譯後如表1所示。Opdivo對黑色素瘤的客觀緩解率達到35%,對比來看,仍處於研究階段的Pidilizumab就有些差強人意,僅有6%的客觀緩解率。在2016年初,FDA暫停了Pidilizumab的部分臨床試驗。PD-1/PD-L1靶點研發火爆,但並非都是道路平坦。
國內研發申報情況
根據CFDA及CDE網站提供的數據,目前國內暫無抗PD-1單克隆抗體獲批生產。但臨床研發活躍,主要涉及4家國外企業和4家國內企業的8個產品。
2016年1月28日,沃森生物子公司嘉和生物研發的抗PD-1單抗(傑諾單抗注射液)產品臨床研究申請獲得CDE的受理。至此,國內共有4個廠家參與到PD-1/PD-L1的激烈爭奪戰中,包括恒瑞、百濟神州、泰州君實。默沙東、BMS、羅氏、阿斯利康也在積極開展該類藥物中國的臨床試驗(見表2)。
國外企業在國內的臨床試驗
查詢CDE藥物臨床試驗與登記平台,數據顯示,Nivolumab已在積極開展臨床試驗,BMS於2013年5月30日向CDE提出該藥臨床申請,是國外該類藥物企業最早在國內申報臨床的。CDE於2015年7月27日批準了該臨床試驗,其用於晚期或轉移性非小細胞肺癌、晚期或複發性實體瘤的臨床試驗正在進行(見表3)。
CDE數據顯示,羅氏的Atezolizumab(MPDL3280A)自2013年12月開始,截至目前一共提交了9個臨床試驗申請,其中一項於2015年11月19日獲得臨床批件。默沙東的Keytruda(pembrolizumab)於2016年1月27日獲得臨床批件。阿斯利康的Durvalumab(MEDI4736)在2015年12月提交了臨床試驗申請,CDE正在審核中。
國內企業的臨床試驗開展
3月2日,中山大學腫瘤防治中心貼出了招收國產人源化抗PD-1單抗患者的通知,臨床試驗使用的是泰州君實生產的國產重組人源化PD-1單克隆抗體注射液JS001。
泰州君實的重組人源化抗PD-1單克隆抗體注射液在2015年12月獲得CDE臨床批件,成為國內首家PD-1單抗獲批臨床的企業,該藥預計將在2020年上市銷售。
隨後,在2016年1月20日,江蘇恒瑞的SHR-1210獲得臨床批件。恒瑞與美國Incyte公司在2015年9月達成協議,恒瑞醫藥將具有自主知識產權的SHR-1210項目有償許可轉讓給美國Incyte公司,交易額達7.95億美元,這是中國企業首次實現了從進口美國醫藥技術變成出口創新藥技術的轉變。
百濟神州與嘉和生物的PD-1藥物臨川申請仍在受理中。2016年1月,百濟神州的PD-1單抗BGB-A317通過FDA的新藥研究申請審評,可在美國開展臨床試驗。嘉和生物的傑諾單抗注射液主要的潛在適應症包括各種血癌及黑色素瘤、非小細胞肺癌、腎癌等多種實體瘤,是目前最後申報的企業。
組合療法的利弊衡量
PD-1單抗開發火爆,各大企業紛紛開展外部合作,火速推進各自的臨床項目,設想並嚐試與各種上市或沒上市的藥物聯用,以徹底發掘該類藥物的最大臨床潛力。
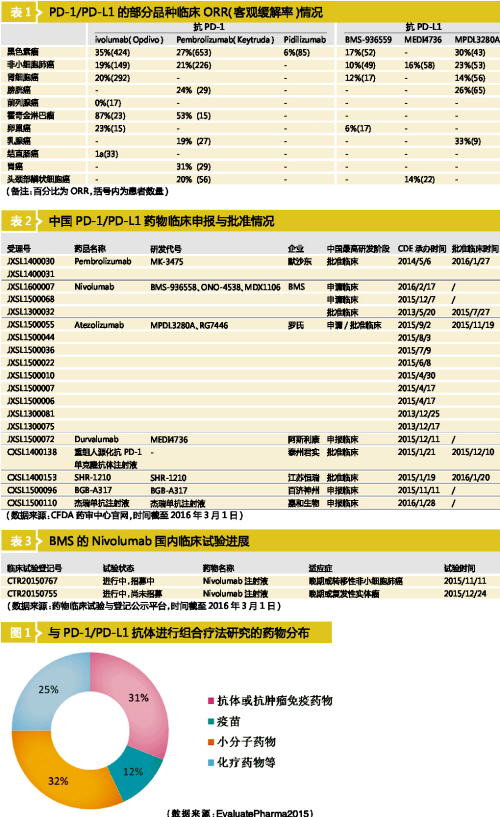
EvaluatePharma的報告顯示,目前有多家企業在研究PD-1/PD-L1抗體與其他藥物的組合,組合藥物包括疫苗、小分子藥物、化療藥物、免疫抑製劑等。從數據來看,與其他藥物組合的研究占據了31%(見圖1)。
2015年10月,FDA批準Opdivo與Yervoy(ipilimumab,依匹木單抗)合並用於黑色素瘤患者治療,Yervoy是CTLA-4抑製劑。這是首個也是唯一一個獲FDA批準用於癌症的兩聯免疫腫瘤藥物療法。
不過,目前生存期延長2.5~6個月才被認為具有臨床意義,何種藥物組合可達到這個新標準還有待研究。應深入開展多種臨床試驗,從而發現免疫治療藥物的最佳用藥方案。
此外,免疫療法也顯示出比較嚴重的副作用,尤其是複方組合。根據適應症的不同,免疫療法與不同的化療或靶向療法組合,但有些組合毒性太大,療效一般。所以,免疫療法到底能對多少腫瘤起到重要作用還有待觀察。
2015下半年,FDA曾緊急叫停了一個臨床試驗。這個試驗是PD-1抑製劑和靶向藥物AZD9291的聯合用藥,同時使用這兩個藥物毒性增強,病人不能耐受。
結語
據花旗預測,2020年PD-1/PD-L1抗體全球市場規模將達到350億美元,2015-2020年複合增長率達到驚人的61%。未來10年,將有超過60%的癌症患者接受免疫治療。免疫治療的良好療效、廣闊的市場空間,吸引著眾多藥企巨頭投入其中。
我們看到,在抗腫瘤領域,國內企業一直緊跟國際研發潮流,加上國家政策的支持,相信國內患者很快就能用上該類藥物。
醫學的發展總會給我們帶來希望,未滿足的臨床需求終會被滿足。















 相關新聞
相關新聞