根據 Insight - China Pharma Data 數據庫,CDE 完成審評的 9504 個注冊申請中,新藥、仿製藥、進口和補充申請對應的審評結論分布情況如下:
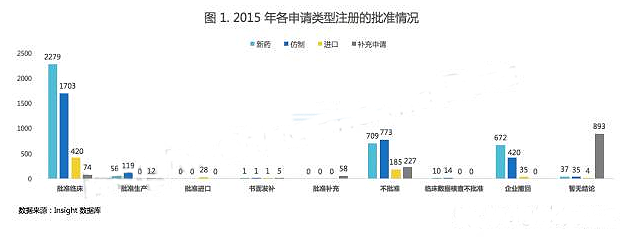
根據圖 1,新藥申請中,大多數為批準臨床、不批準和企業撤回,當然也不乏批準生產上市的申請。
仿製藥申請中,批準上市數量為新藥的 2 倍,但不批準數量要多於新藥。
而進口藥申請中,除了批準臨床申請以外,還有不少撤回和不批準的注冊申請。
以下,來看各審評結論的具體情況。
一、批準臨床
2015年,化藥共有4477個受理號批準臨床,其中1.1類新藥有155個,3.1類新藥1645個。
1、江蘇恒瑞一年5個1.1類新藥獲批臨床
Insight數據庫統計,2015 年共有50個企業獲得了1.1類新藥臨床批件,涉及63個新藥成分詞,其中有9個企業一年的新藥臨床批件個數在2個及以上。
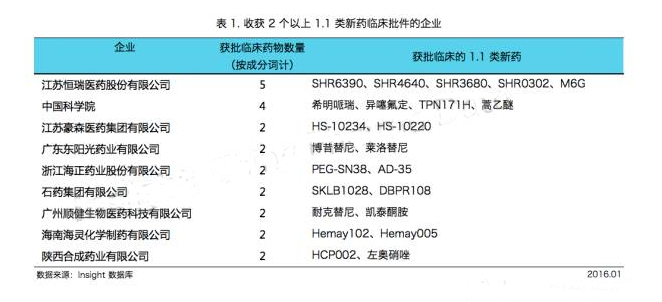
除了廣州順健專攻 1.1 類新藥以外,其他大多數企業都是從做仿製藥轉型而來。
可見,新藥物研發申報潮流中,1.1 類新藥不再是少數企業的寵兒,相反有越來越多的企業開始有實力參與其中。
2015 年,江蘇恒瑞收獲了 5 個 1.1 類新藥的臨床批件,一如既往地排名第一。
中國科學院上海藥物研究所緊隨其後,拿到了 4 個新藥的臨床批件。
江蘇豪森、廣東東陽光、浙江海正和石藥集團等企業也不甘在仿製藥和首仿藥領域,在創新藥領域也收獲滿滿。
2、正大天晴首仿藥臨床批件排名第一
3.1 類臨床申請審評所在的驗證性臨床隊列是 CDE 今年的主要工作,從成績來看,2015 年共有 1645 個 3.1 類新藥獲批臨床(以受理號計)。
2015年首仿藥批準臨床的版圖中(如表2所示),排名第一的是正大天晴,有70個注冊申請獲批臨床,申報數量最多的南京華威公司今年獲得的臨床批件數量排第二,江蘇豪森則排名第三。
毫無意外的是,這一年羅欣、齊魯、科倫、石藥在首仿藥臨床申請這場角逐中勝出,名列前七。
二、批準上市
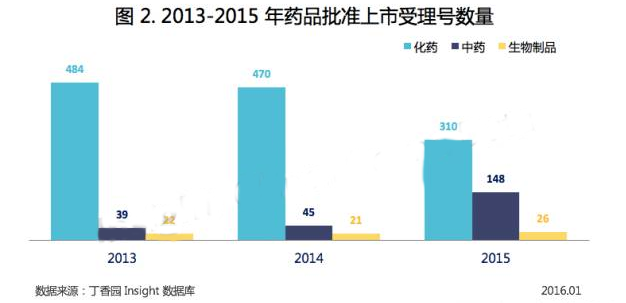
2015年,共有484個受理號批準上市(包括批準生產、批準上市、批準進口),與2014年相比減少了9.7%,然而減少的隻有化藥,中藥和生物製品的批準數量都有增加,尤其是中藥,批準數量翻了3倍。
1、化藥:華邦穎泰 1 類複方製劑批準上市
2015 年,CFDA 共批準化藥上市 310 件(以受理號計)。
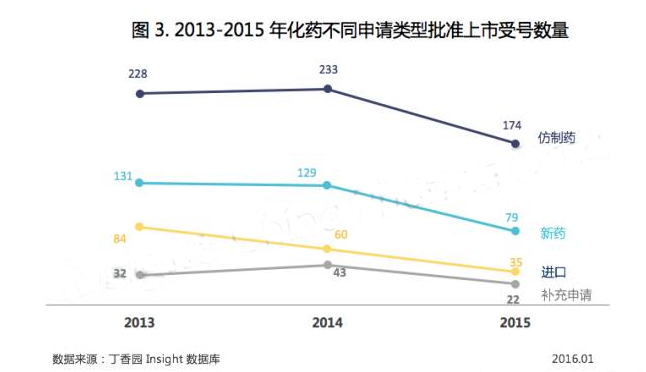
上半年審批盤點時,仿製藥批準數量下降而新藥和進口批準數量變化不是很大,但到了下半年,新藥和進口化藥批準上市數量也開始減少,相比 2014 年下降了 25% 以上(見圖 3)。
化藥批準數量劇減的這一年,CFDA 共批準了 14 個化藥品種首次在中國上市(見表 3)。
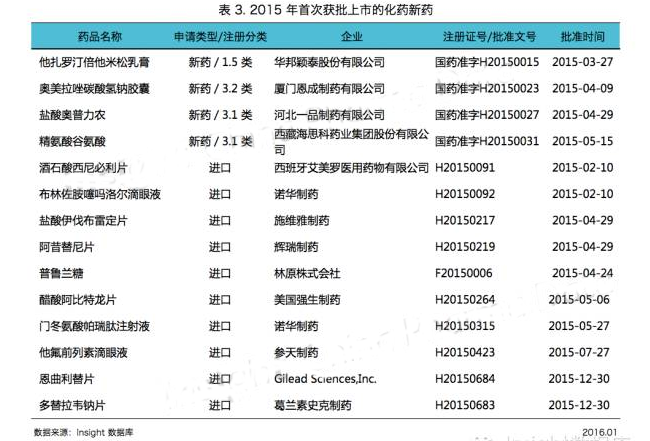
今年首次獲批上市的 1 類新藥為華邦穎泰(華邦健康 SZ:002004)的新型複方製劑他紮羅汀倍他米鬆乳膏。
首次上市的 3 類新藥有西藏海思科河北一品製藥的鹽酸奧普力農注射液、西藏海思科的精氨酸穀氨酸注射液,以及廈門恩成的複方藥奧美拉唑碳酸氫鈉膠囊。
除此以外,其他首次獲批上市的藥品大多都落入了外資企業囊中(見表 3)。
2、中藥:湖南方盛 7 個中藥品種獲批上市
2015 年,CFDA 共批準中藥上市 148 件(以受理號計)。

如圖 4 所示,2013-2014 年幾乎沒有中藥批準上市,2015 年,雖然國家局在忙乎現場檢查核查和集中審評,不料也批了許多中藥品種。批準上市的中藥大多為 2005-2006 年申報的 8 類改劑型新藥,所批品種包括口服固體製劑、口服液體製劑以及外用軟膏劑等。
其實上半年中藥批準突增已初見端倪,等下半年結束,中藥批準上市數量已增長為 2014 年的 3 倍。
奇怪的是,2015 年喧鬧的改革政策中,並沒有筆墨倚重中藥,也沒有特別的利好政策,難道中藥的春天要來悄悄地來臨了嗎?國家局一邊現場核查臨床試驗、重視仿製藥一致性評價,但另一邊卻批準了許多中藥上市。
國家局的心思我們永遠猜不透。
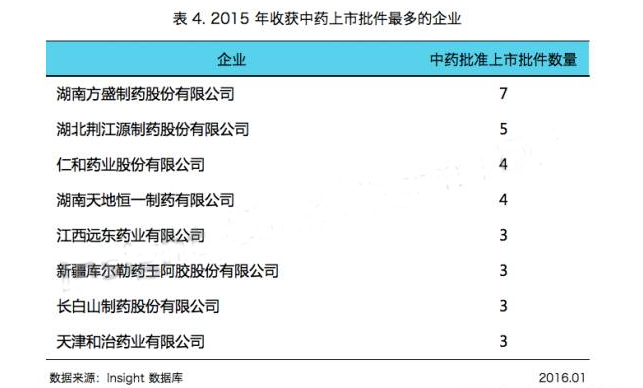
如表 4 所示,湖南方盛、湖北荊江源、仁和藥業等中藥領域的企業在 2015 年滿載而歸:
3、生物製品:醫科院醫學生物研究所 2 個疫苗批準上市
2015 年,CFDA 共批準生物製品上市 18 件(以受理號計)。
其中,首次獲批上市的 2 個 1 類生物製品均由中國醫學科學院醫學生物學研究所研發。
一個是用於兒童預防脊髓灰質炎病毒感染的 Sabin 株脊髓灰質炎滅活疫苗,該疫苗的上市填補了中國在脊髓灰質炎滅活疫苗生產領域的空白。
另一個是腸道病毒71型滅活疫苗(人二倍體細胞),這個疫苗的上市對降低中國兒童手足口病的發病率有重大意義。
三、企業撤回
臨床試驗自查核查風暴是 2015 年十大醫藥事件之一。
截至目前為止,722 公告中的注冊申請中,不通過率達 73%(按 722 公告的全部自查核查品種計算),其中有 70.9 % 的注冊申請已經撤回,涉及 488 個企業(合並子公司),撤回了 1150 個注冊申請(包括推測已經撤回的注冊申請)。
在這次大規模的運動中,撤回的企業情況如表 5 所示:
眾所周知,浙江華海撤回數量最多,撤回了 19 個注冊申請。
另外,石藥集團、江蘇豪森、江蘇恒瑞、深圳致君等企業都撤回了十餘個受理號。
四、不批準
2015 年,CFDA 給出不批準的藥品注冊申請共 2033 件(以受理號計,不區分申請內容)。
在化藥各個申請類型中,不批準最多的是仿製藥,共 774 個,占所有仿製藥結論的 25%,也就是說,這一年化藥仿製藥的不批準率為 25%。
其次是新藥申請,有 709 個注冊不被批準,不批準率為 20.5 %。
對外資企業來說情況也不是很樂觀,進口化藥不批準注冊數量為 185 個,不批準率為 27.9 %。
而即使是「萬精油」 般的補充申請也有 227 個不予批準,不批準率為 16.4%。
到底是哪些企業如此「不幸」,拿到了最多的不批準結論呢?
新藥申報中,申報數量一直居榜首的江蘇恒瑞有39個注冊申請不予批準;仿製藥企業海南日中天製藥有40個注冊申請被斃;外資企業中,諾華、禮來、強生、輝瑞、拜耳等企業都沒能幸免。





















 相關新聞
相關新聞