隨著中國經濟的高速發展以及不斷推進的藥政改革,中國醫藥行業迎來了新的機遇。無論是新藥還是仿製藥,其開發所必備的“資金、技術、人才、政策”等條件正逐漸成熟,中國醫藥行業已經迎來了健康快速發展的新時期。
【全球藥物研發特點】
“創新藥、改良型新藥、仿製藥”齊頭並進
筆者首先從創新藥、改良型新藥及仿製藥三種藥物類型,分析全球藥物研發的動態和特點。
創新藥:仿而優則創
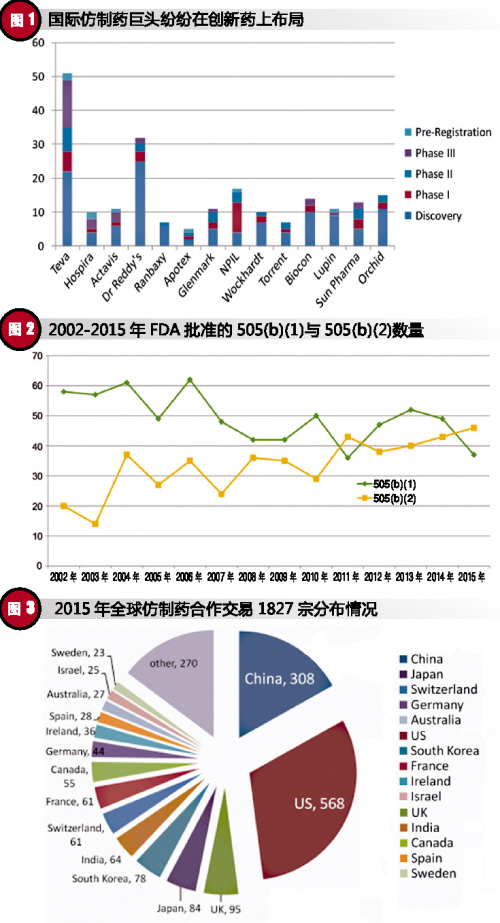
從創新藥角度來看,除大家耳熟能詳的Pfizer、Roche、J&J、Sanofi等跨國製藥巨頭外,仿製藥領域巨頭也紛紛在創新藥上布局,並取得了一係列的成績。以創新藥開發數量最多的Teva為例,其銷售收入大約有一半來源於創新藥。這一點充分體現了“仿而優則創”的必然趨勢。
整體來講,經過仿製藥的初步積累,中國創新藥最近幾年也飛速發展。目前,已經初步呈現出從Me-too/Me-better向First-in-class/Best-in-class階段的發展。其中,恒瑞醫藥、正大天晴、先聲藥業等國內知名企業已經開始引領這個趨勢。
改良型新藥:永恒的創新類型
從藥物生命周期的管理角度,跨國製藥巨頭們或多或少都會在已有產品的基礎上進行產品的改良和升級。從收入占比來看,跨國製藥巨頭平均有超過1/4的銷售收入來源於改良型新藥。
從全球新藥獲批數量來看,改良型新藥已經成為新藥研發的一種趨勢。以美國為例,從2002~2015年FDA批準的新藥類別及數量來看,在2010年前後發生了明顯的變化。2010年之前,505(b)(1)占主導,2010年之後,505(b)(2)呈上升趨勢,並逐漸趕超505(b)(1),2015年505(b)(2)以46:37的比例超過505(b)(1)。改良型新藥已經成為全球新藥研發的必不可少的一部分。
值得一提的是 “藥械結合”的幹粉吸入劑,具有廣闊的市場前景,立誌於創新的企業可以關注和挖掘。這個領域的產品開發技術難度高、投入大,而一旦成功,產品的市場獨占期會很長,投資回報率也很高。
仿製藥:高端仿製藥快速發展
仿製藥方麵,最值得關注的是中國仿製藥出口情況。最近幾年,中國仿製藥發展迅速。截至目前,中國共13家製藥公司持有104個仿製藥文號。此外,還有很多中國企業的ANDA正在申報中。藥品出口類型也逐漸從單純的API向高附加值的高端製劑轉變。未來,中國企業的高端仿製藥將迎來高速發展期。
【中國藥企麵臨機遇】
“資金、技術、人才、政策”條件逐漸成熟
中國製藥走上國際舞台
過去的10年裏,全球醫藥行業內的合作與並購層出不窮,交易數量及交易額也逐漸呈上升趨勢。
相比於並購成就的創新藥巨頭Pfizer,印度公司Jubilant則是並購造就的仿製藥巨擘。Jubilant最初為印度的小型製劑研發型公司,年產值僅一兩千萬美元。從上世紀70年代開始,經過大大小小的30多次並購,Jubilant目前已經成為年收入10億美元以上的大型跨國公司。其業務也從最初的仿製藥,拓展到Biosimilar及創新藥領域。
2015年,全球範圍內圍繞“仿製藥”開展的合作交易共有1827宗,交易額高達3110億美元。其中,已經完成或處於活躍狀態的有1373宗,交易額1804億美元。
從並購主體的國家及數量來看,美國公司最多,為568家。其次為中國,共308家。這一點,充分體現了中國製藥企業積極拓展國際市場的勇氣和決心,中國製藥公司已經走上了國際舞台。
與發達國家的三個差距
雖然中國目前高端製劑出口正逐步創收,創新藥研發也初具規模,但總體來講,中國醫藥行業與發達國家相比差距還很大。主要體現在3個方麵:
◎中國為製藥大國,仍非製藥強國。製藥企業多,但利潤率低,研發投入不足。
◎創新能力仍顯薄弱。目前仍處於仿製為主到仿創結合的階段,仿製藥數量高達96%,創新藥也多以me-too為主。
◎產研聯盟作用虛化,缺乏有效機製體製和運作實體。
以2013年為例,排名前十的中國製藥公司與國際製藥公司相比,其銷售額、利潤、研發投入及成果轉化率等相差甚遠。
藥審製度與全球接軌
值得慶幸的是,從全球藥品注冊的視野來看,中國與發達國家的藥物研發審評體係正在加速接軌。
從2015年1月發布的《國際多中心藥物臨床試驗指南(試行)》,到2015年4月份發布《中華人民共和國藥品管理法》修訂版,再到2015年7月22日開展的臨床自查,一直到2016年頒布的新藥品注冊分類、仿製藥一致性評價等法規新政,均體現了國家在解決審評積壓、提高藥品質量、鼓勵創新等方麵的決心。
結語
中國藥企通過自主研發及海外並購等途徑,已經走上了國際舞台。通過這些途徑,已經初步積累了藥物開發所必須的資金、技術、人才。隨著法規新政的不斷深入和完善,以及中國老百姓日益擴大的用藥需求,中國藥企也迎來了前所未有的機遇。














 相關新聞
相關新聞