年終盤點近年來FDA新藥批準概況
截止到2016年12月9日,FDA全年共接收到了36個新分子實體(NEM)的申請,與過去10年的平均水平基本相符合。十幾年來,FDA雖然批準率逐年遞升,但其工作量和效率仍然變化不大。看看下麵這些概況分析,也許你能找到順利FDA新藥批準的最佳時機。
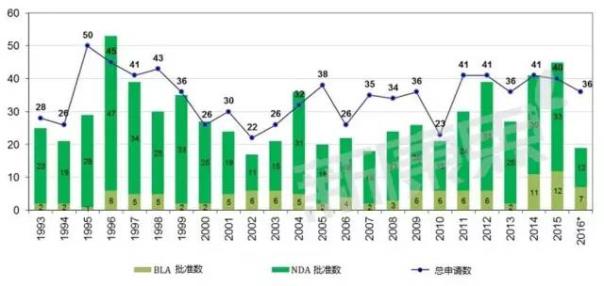
新分子實體批準情況
NME(New Molecular Entity )
新分子實體包括兩類:一類是NDA(new drug approval)即新藥上市許可申請,另一類是biologicslicense application (BLA)即生物製品上市許可申請。
從1994年到2016年12月FDA接受到的申請和批準情況如下圖所示:
截止到2016年12月9日,FDA全年共接收到了36個新分子實體(NEM)的申請,與過去10年的平均水平基本相符合(平均數為35),其中有19個新分子實體被批準,包括12種新藥上市許可(NDA)和7種生物製品許可(BLA)。這19種藥物中又包括了7種孤兒藥,2016年的批準數目與2015年相比有較大的下滑,2015年共被批準45種新藥,其原因包括以下幾個方麵:有5種NME計劃2016年批準,被提前到2015年;2016年申請的數目相對較少; 2016年發布的全項審評意見函(CR)較多。
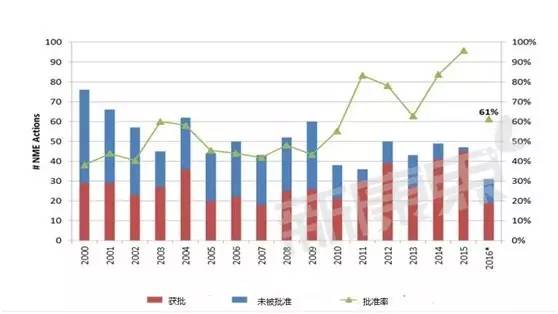
批準率變化情況
上圖統計了每年提交的NME申請最終被批準的情況,值得說明的是2015年提交的申請不一定在當年就被批準,有可能過一年甚至數年才被批準;同時被退回重新申請的被批準之後也統計為獲得批準;另外,一次性申請多種劑型、多種適應症的情況視為一次申請。可以看到從2010年開始,批準率有逐年升高的趨勢,2016年較低是因為有的申請還在審理之中,不能被歸為獲得批準一類裏。
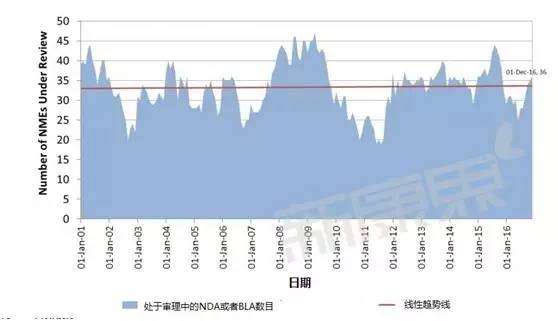
處於審理之中的藥物數量變化情況
處於審理中的新分子實體數目是個連續的動態變量,不太好用分類變量常用的直方圖表示,因此上圖采用了線性的陰影麵積圖。可以看到FDA正在處於審理中的新分子實體數目保持在33個左右,最近十幾年其工作容量和效率變化不大。
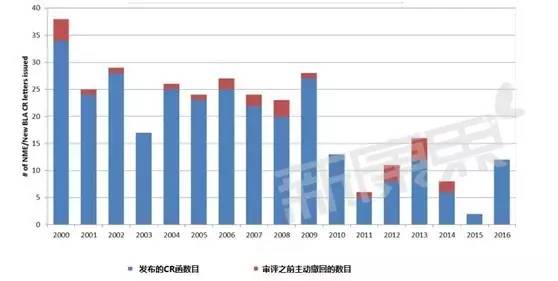
FDA發布的的全項審評意見函(Complete Response letters)數目變化
所謂全項審評意見函(Complete Response letters)類似於國內的補充通知,是FDA以書麵的形式向申請者發送的函件,其中完整描述了FDA發現的提交申請資料中所有缺陷和不足之處,指導申請人補充資料以便能夠獲得批準。可以看到最近幾年CR函有逐年減少的趨勢,2015年降低到曆史最低點,因此這一年被批準的新藥也最多,而2016年CR函件又多了起來,今年被批準的新藥也有所回落。
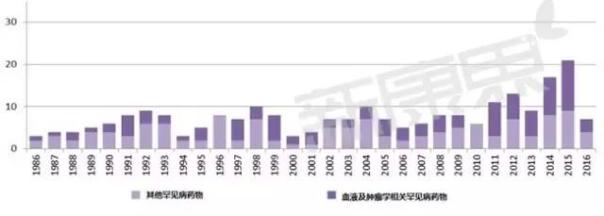
罕見病藥物審批情況
FDA很早就給出了罕見病的定義,罕見病由於患病人數較少,因此藥物開發很難獲利。為解決這一問題,FDA給予了罕見病藥物孤兒藥研發企業很多優惠條件,這樣罕見病藥物也成了各大生物醫藥公司研發的熱門,從上圖中也可以看出罕見病治療藥物被批準的數目也有逐年上升的趨勢。

分享到:














 相關新聞
相關新聞