Insight數據庫用權威的數據和大家一起回顧過去半年藥品的申報受理情況,及時掌握中國藥品注冊的動態和趨勢。
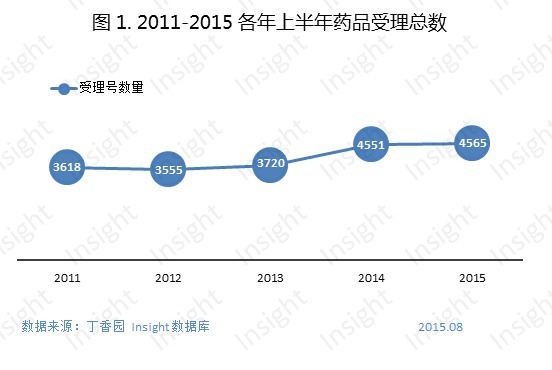
根據Insight-China Pharma Data數據庫統計,2015上半年CDE共承辦新的藥品注冊受理4565個(以受理號計,見圖1)。與過去四年同期相比,藥品受理號數量雖然持續增加,但與2014上半年比較,幾乎持平。
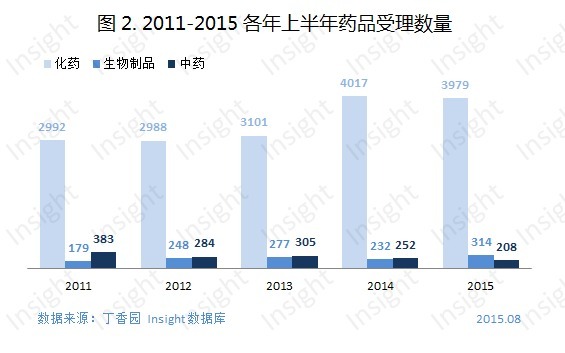
具體看來(見圖2),化藥申報數量與2014年相比有所下降,中藥申報數量降幅為16.7%,隻有生物製品申報數量與同期相比有所增加,且漲幅達35.3%。3月出台的《生物類似藥研發與評價技術指導原則》填補了國內空白,生物藥市場也越來越被看重,申報數量增加也在預料之中。
以下,分別回顧化藥、生物製品和中藥的具體申報情況。
一、化藥申報受理情況
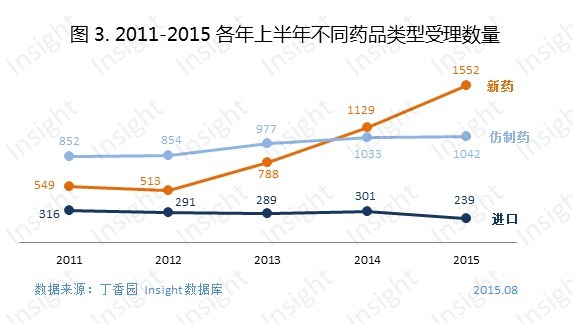
一直處於上升趨勢的化藥申報數量在2015年有所回落,從下圖可知,申報數量的回落主要體現在進口藥、進口再注冊和補充申請這幾種申請類型的減少,而一貫被詬病重複申報的仿製藥數量與去年同期相比沒有大幅上升,無過但也無功。
1、新藥
迅猛增長的新藥申報數量要「歸功於」3.1類新藥的搶仿熱潮,從2014到2015年,上半年3.1類新藥申報數量同期增長了46%,1.1類新藥的申報數量則理性增長,保持穩定。
(1)1.1類新藥
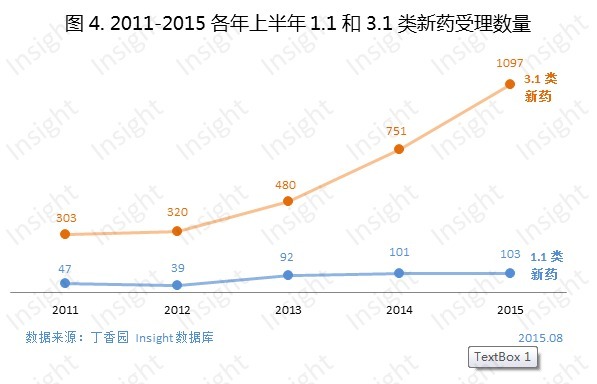
2015上半年,新申報的化藥1.1類新藥申請以受理號計有103個,包括2個1.1類新藥品種申報上市,37個1.1類新藥品種申報臨床:

其中,北京康辰藥業股份有限公司的注射用鹽酸諾拉曲塞和江蘇恒瑞的磷酸瑞格列汀片申報生產,根據Insight數據庫的預測,鹽酸諾拉曲塞和磷酸瑞格列汀片有望於2016年上半年和下半年分別獲批生產。
另外,在39個1.1類新藥中,除了精華製藥的倍他替尼、廣東東陽光的焦穀氨酸榮格列淨、河北菲尼斯的FNS007以外,其他都屬於特殊審評品種,有6個品種還同時被列入了重大專項審評,分別是:廣州市香雪的科特拉尼、北京康辰的鹽酸諾拉曲塞、深圳明賽瑞霖的希列克托靈、重慶複創醫藥的丁二酸複瑞替尼、鄭州大學的布羅佐噴鈉,以及上海醫藥的SPH3127。
(2)3.1類新藥
除了藥品專利懸崖期引發的搶仿熱以外,越來越快地搶仿申報趨勢也使得3.1類新藥申報數量大幅增長。2015上半年,新申報的化藥3.1類新藥申請以受理號計有1097個。
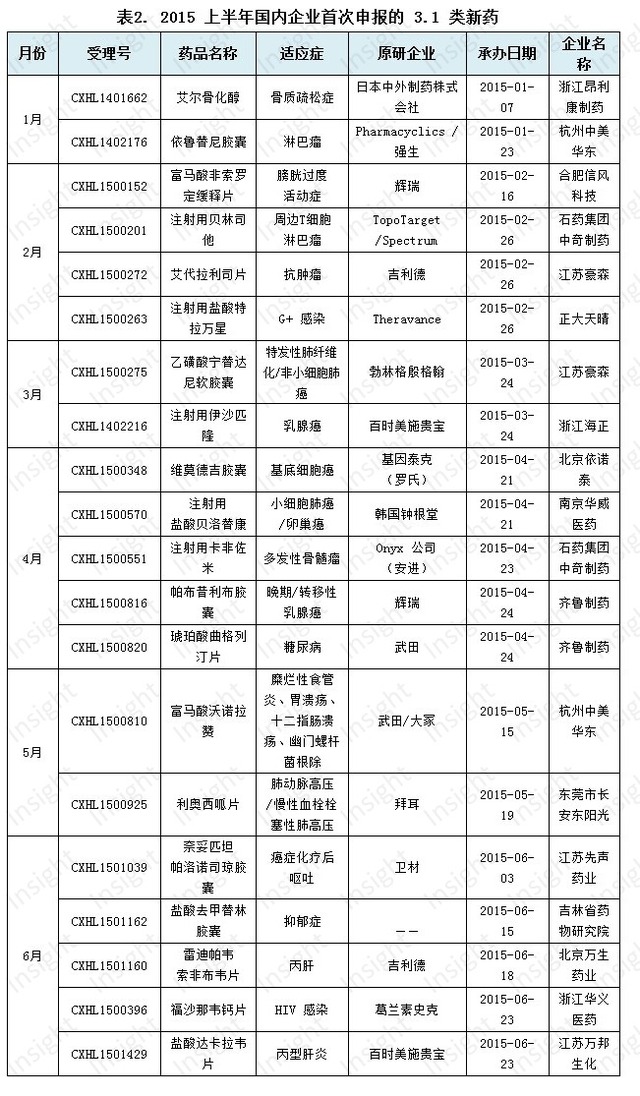
2、仿製藥受理情況
仿製藥申報增速放緩
過去四年,積壓的藥品審評大多數是仿製藥,重複申報問題非常嚴峻。2015年上半年,新申報的仿製藥申請以受理號計有1042個,僅比去年多了不到10個(見下圖),申報數量的增速開始放緩。
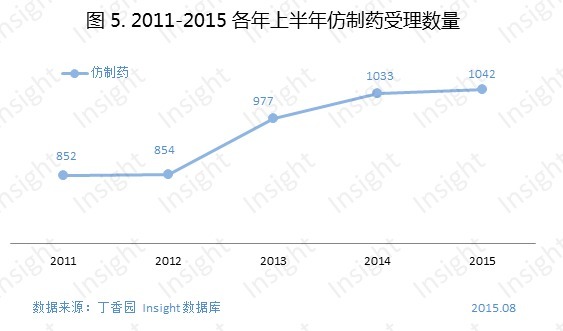
3、進口藥
進口化藥申報縮水20.6%
化藥的申報受理相比去年同期有所減少,其中一部分減少來自於進口藥申報數量的減少。2015上半年新申報的進口化藥申請以受理號計有239個,比去年同期下降了20.6%,不僅如此,進口再注冊申報數量也下降了22.7%。
根據Insight數據庫7月藥品審評報告,7月份進口藥品申報數量達2015 年最高,但相比 2014 年同期仍呈下降趨勢。
這也許是因為較慢的藥品審評速度使得外資企業對中國的信心有所減弱,因此進口藥和進口再注冊申報受理數量的減少也就不足為奇了。
然而,隨著 140 號文件中提高仿製藥審評標準等政策實施,局麵將利好原研藥。
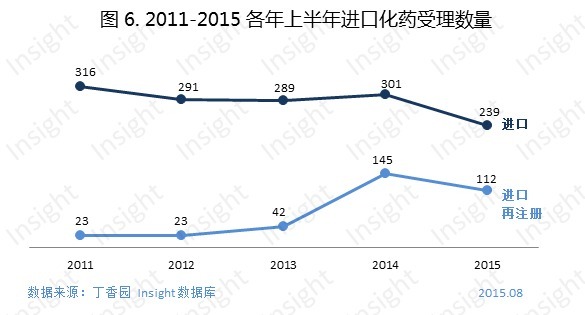
二、中藥申報受理情況
2015 上半年新申報的生物製品申請以受理號計共有 208 個,具體申請類型如下圖:
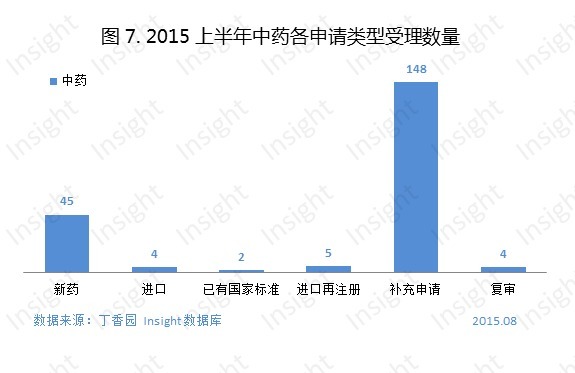
三、生物製品申報受理情況
2015 上半年新申報的生物製品申請以受理號計共有 314 個,具體申請類型如下圖:
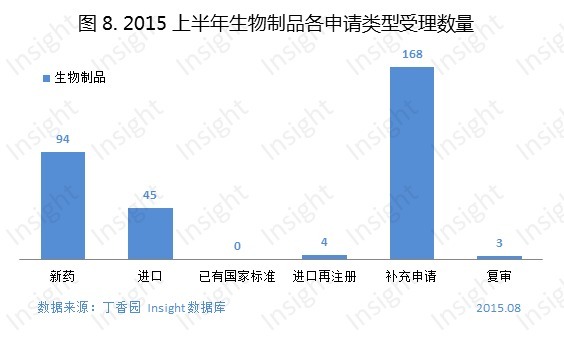
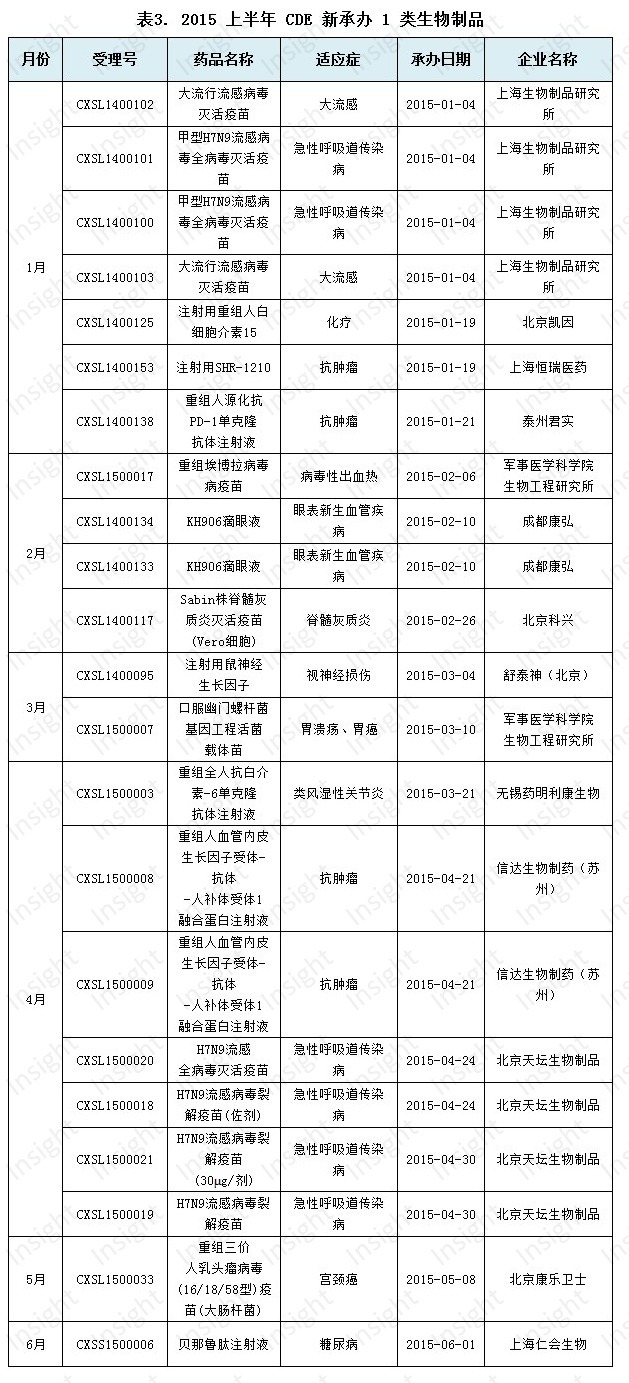
其中,有 1 個 1 類新藥申報上市,為上海仁會生物製藥的貝那魯肽注射液;有 14 個 1 類新藥申報臨床,具體如下:

























 相關新聞
相關新聞