
EN

藥物臨床試驗數據自查,是CDE的一箭雙雕之策嗎?
2015年3月6日,國家衛生計生委副主任孫誌剛在政協醫衛小組表明觀點稱:“藥品招標采購中就是唯價格論。質量不是招標出來的,是生產出來的,是檢驗保障的,是藥監局的事。”自此之後,藥監局開始整改中藥飲片、銀杏提取物、生化藥,飛行檢查變得越來越普遍,GMP證書被取消的新聞幾乎每天都可以在行業新聞中見到,現在藥監局又將工作瞄向了藥物臨床試驗數據。
7月22日,國家食品藥品監督管理總局發布了《關於開展藥物臨床試驗數據自查核查工作的公告(2015年第117號)》,藥物臨床試驗數據自查核查品種清單共公布了1622個受理號,其中進口有171個受理號,新藥948個受理號,已有國家標準503個受理號。化藥需要自查1283個受理號,占79.1%,中藥大多是2005年至2006年的受理號,共237個,占14.6%。生物製品共102個受理號。
按鹹達數據V3.1對省份的監測,江蘇排名第一,199個受理號需要自查;其次是山東136個受理號;浙江排名第三,共120個受理號;北京117個受理號排第四;廣東緊跟在後,共116個受理號;上海以47個受理號排名第十。
產品通用名方麵,共968個通用名涉及本次自查,其中苯磺酸氨氯地平片需自查的受理號數最多,共19個;瑞舒伐他汀鈣片有17個自查受理號,排第二;奧硝唑片以14個受理號排第三;排第三的多潘立酮片共12個受理號;拉米夫定片和硫酸氫氯吡格雷片各以11個受理號並列第四。達沙替尼片、人免疫球蛋白、法羅培南鈉片、奧硝唑片、鹽酸帕洛諾司瓊注射液、苯磺酸氨氯地平片和注射用頭孢替坦二鈉是國內上市公司主要需要自查的產品,每個通用名中各有4個受理號涉及自查。
1622個受理號中有309個受理號分別屬於國內103家上市公司。華海藥業涉及的(SH600521)受理號數最多,分別是纈沙坦片、纈沙坦氫氯噻嗪片、坎地沙坦酯氫氯噻嗪片、替米沙坦片、左乙拉西坦片、米格列奈鈣片、非布司他片、草酸艾司西酞普蘭片和拉莫三嗪片。若以藥品名稱數排名,排第一的是恒瑞和國藥一致,各14個產品名需要自查。
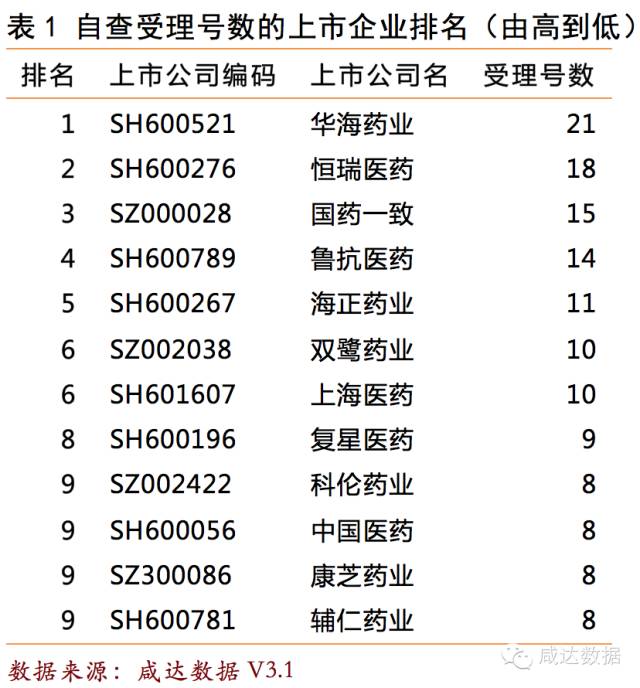 共27個申報1類或1.1類的產品名需要自查,其中9個屬於上市公司,包括天津紅日的對甲苯磺酰胺注射液,江蘇恒瑞的磷酸瑞格列汀片和鹽酸卡屈沙星葡萄糖注射液,貴州景峰的黃芪甲苷葡萄糖注射液,上海仁會生物的貝那魯肽注射液等產品。
需要自查的受理號中,有13個受理號屬於重大專項,國內上市公司占了8個受理號。21個受理號數屬於特殊通道,國內上市公司占了11個;加快品種共有7個受理號需自查,其中有一個屬於國內上司公司。
共27個申報1類或1.1類的產品名需要自查,其中9個屬於上市公司,包括天津紅日的對甲苯磺酰胺注射液,江蘇恒瑞的磷酸瑞格列汀片和鹽酸卡屈沙星葡萄糖注射液,貴州景峰的黃芪甲苷葡萄糖注射液,上海仁會生物的貝那魯肽注射液等產品。
需要自查的受理號中,有13個受理號屬於重大專項,國內上市公司占了8個受理號。21個受理號數屬於特殊通道,國內上市公司占了11個;加快品種共有7個受理號需自查,其中有一個屬於國內上司公司。
 曾經一度不被批準的默沙東重組人乳頭瘤病毒(6型,11型,16型,18型)疫苗(酵母),GSK的人類乳頭瘤病毒吸附疫苗也在本次自查的名單中,類似的產品還有京玉清肝膠囊、13種複合維生素注射液和百令片。曾經狀態為“批準生產”的102個受理號也同樣麵臨自查,有11個受理號屬於國內上市企業。
小結
為落實黨中央、國務院用“最嚴謹的標準、最嚴格的監管、最嚴厲的處罰、最嚴肅的問責,確保廣大人民群眾飲食用藥安全”的四個最嚴要求,藥監局開始對已申報生產或進口的待審藥品注冊申請開展藥物臨床試驗數據核查。申請人自查發現臨床試驗數據存在不真實、不完整等問題的,可以在2015年8月25日前向國家食品藥品監督管理總局提出撤回注冊申請。
“藥品審評過程中,發現申請人有下列情形之一的,將依據《藥品注冊管理辦法》第一百五十四條的有關規定,注冊申請不予批準。包括:(一)拒絕、逃避或者阻礙檢查或者毀滅證據的;(二)臨床試驗數據不能溯源,數據不完整的;(三)真實性存疑而無合理解釋和證據的;(四)未提交自查報告的。對核查中發現臨床試驗數據真實性存在問題的相關申請人,3年內不受理其申請。國家食品藥品監督管理總局將組織專家對申請人的自查材料等進行數據分析並視情況開展飛行檢查。檢查中發現臨床試驗數據弄虛作假的,臨床試驗數據不完整不真實的,將依據《中華人民共和國藥品管理法》第七十八條、《藥品注冊管理辦法》第一百六十六條的有關規定,追究申請人、臨床試驗機構、合同研究組織的責任,並向社會公開申請人、臨床試驗機構、合同研究組織及其法定代表人和相關責任人員。”
這1622個受理號中,不少是2008年以前的受理號。CDE曾經承諾3年內解決藥品申報積壓的事宜,但目前處理能力有限,遠遠比不上藥企申報產品的熱情。以目前對臨床數據的高要求去自查2008年以前申報的臨床項目,基本沒有多少項目能符合要求現有的標準。企業若不主動撤回注冊申請,大多項目曆史數據都不完整,現在重做也比較不現實,按規定數據不完整也要受罰。博弈後項目數據不過關的產品企業隻能選擇撤退。通過臨床數據自檢讓藥企知難而退,順道還解決了一大批受理號積壓的事宜,藥監局此舉可謂一箭雙雕。
對於企業而言,隻有持久高標準要求的企業才能應對日益法規從嚴的政策,以往得過且過的態度將難以渾水摸魚了。
曾經一度不被批準的默沙東重組人乳頭瘤病毒(6型,11型,16型,18型)疫苗(酵母),GSK的人類乳頭瘤病毒吸附疫苗也在本次自查的名單中,類似的產品還有京玉清肝膠囊、13種複合維生素注射液和百令片。曾經狀態為“批準生產”的102個受理號也同樣麵臨自查,有11個受理號屬於國內上市企業。
小結
為落實黨中央、國務院用“最嚴謹的標準、最嚴格的監管、最嚴厲的處罰、最嚴肅的問責,確保廣大人民群眾飲食用藥安全”的四個最嚴要求,藥監局開始對已申報生產或進口的待審藥品注冊申請開展藥物臨床試驗數據核查。申請人自查發現臨床試驗數據存在不真實、不完整等問題的,可以在2015年8月25日前向國家食品藥品監督管理總局提出撤回注冊申請。
“藥品審評過程中,發現申請人有下列情形之一的,將依據《藥品注冊管理辦法》第一百五十四條的有關規定,注冊申請不予批準。包括:(一)拒絕、逃避或者阻礙檢查或者毀滅證據的;(二)臨床試驗數據不能溯源,數據不完整的;(三)真實性存疑而無合理解釋和證據的;(四)未提交自查報告的。對核查中發現臨床試驗數據真實性存在問題的相關申請人,3年內不受理其申請。國家食品藥品監督管理總局將組織專家對申請人的自查材料等進行數據分析並視情況開展飛行檢查。檢查中發現臨床試驗數據弄虛作假的,臨床試驗數據不完整不真實的,將依據《中華人民共和國藥品管理法》第七十八條、《藥品注冊管理辦法》第一百六十六條的有關規定,追究申請人、臨床試驗機構、合同研究組織的責任,並向社會公開申請人、臨床試驗機構、合同研究組織及其法定代表人和相關責任人員。”
這1622個受理號中,不少是2008年以前的受理號。CDE曾經承諾3年內解決藥品申報積壓的事宜,但目前處理能力有限,遠遠比不上藥企申報產品的熱情。以目前對臨床數據的高要求去自查2008年以前申報的臨床項目,基本沒有多少項目能符合要求現有的標準。企業若不主動撤回注冊申請,大多項目曆史數據都不完整,現在重做也比較不現實,按規定數據不完整也要受罰。博弈後項目數據不過關的產品企業隻能選擇撤退。通過臨床數據自檢讓藥企知難而退,順道還解決了一大批受理號積壓的事宜,藥監局此舉可謂一箭雙雕。
對於企業而言,隻有持久高標準要求的企業才能應對日益法規從嚴的政策,以往得過且過的態度將難以渾水摸魚了。

分享到:
















 相關新聞
相關新聞