
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




2015年10月份美國FDA共審批通過15種新藥,1類新分子實體藥物3個; 新生物藥物2個;3類新劑型藥物5個;4類新組合物1個; 5類藥物新規格或新生產商4個。
表1 2015年10月份美國FDA審批通過新藥
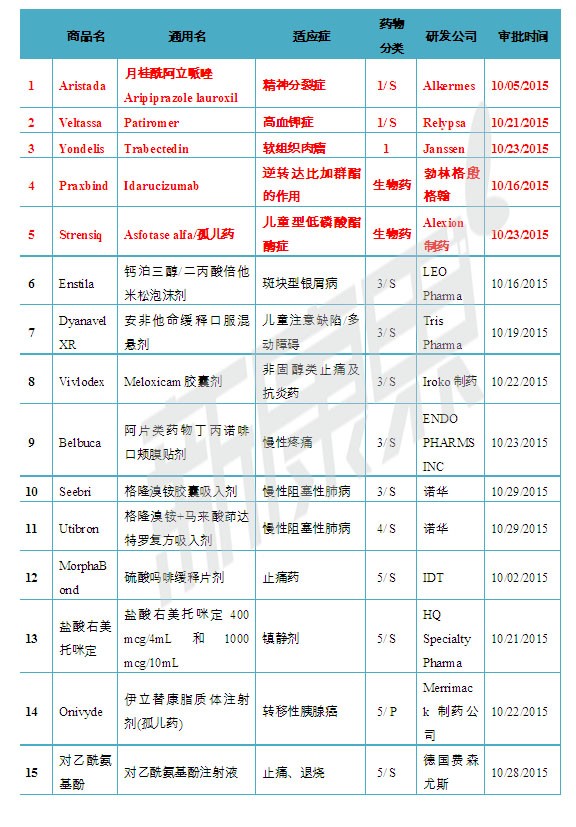
注:1)化學新藥分類:1類新分子實體化合物;3類新劑型;4類新組合物; 5類藥物新規格或新生產商;2)審批分類:P優先評審;S常規評審
2015年10月05日,美國FDA批準了Alkermes公司的新分子實體藥物Aristada(Aripiprazole lauroxil,月桂酰阿立呱唑)上市。Aristada為緩釋注射劑,用於精神分裂症患者的治療。Aristada注射劑共有三種規格,分別含有月桂酰阿立呱唑441 mg、662 mg 和882 mg。精神分裂患者可每月注射441 mg、662 mg 和882 mg 的Aristada一次,或每6周注射882 mg 的Aristada一次。Aristada最常見的不良反應為靜坐不能。Aristada帶有黑框警告,提示患者和醫生Aristada沒有獲得批準用於老年癡呆相關精神病的治療,Aristada超適應征治療老年癡呆相關精神病時或升高死亡風險。
2015年10月21日,美國FDA批準了Relypsa公司的新分子實體藥物Veltassa(Patiromer)上市,用於高血鉀症的治療。Patiromer的作用機製是結合胃腸道中的鉀從而降低鉀的吸收,Patiromer為口服粉末狀藥物,共有8.4克, 16.8克和25.2克三種規格。Patiromer帶有黑框警告,在臨床使用時Patirome由於能與多種藥物結合,從而降低了其他藥物的吸收減弱藥效。因此黑框警告中建議Patiromer和其他任何口服藥物同服時,應間隔6小時以上。
2015年10月23日,美國FDA通過優先審批途徑批準了Janssen公司的新分子實體藥物Yondelis(Trabectedin)上市,用於不可切除或轉移、曾接受過含一種蒽環類藥物化療的脂肪肉瘤和平滑肌肉瘤患者的治療。Trabectedin為烷化劑屬於細胞毒類藥,臨床使用中常見的不良反應包括惡心、疲勞、嘔吐、便秘、食欲下降、腹瀉等。
2015年10月16日,美國FDA批準了勃林格殷格翰公司的新生物藥物Praxbind(Idarucizumab)上市,用於接受抗凝藥達比加群酯治療的患者,在急診手術、介入性操作、或者出現危及生命或無法控製的出血並發症,需要逆轉達比加群酯的抗凝效應時使用。Idarucizumab是一種人源性單克隆抗體片段(Fab),臨床使用時隻與達比加群酯分子特異性結合,可中和其抗凝效應,不會幹擾凝血級聯。
2015年10月23日,美國FDA批準了Alexion製藥公司的新生物藥物Strensiq(Asfotase alfa)上市,用於兒童型低磷酸酯酶症的治療。低磷酸酯酶症為罕見病,是由 ALPL 基因突變引起其編碼的組織非特異性堿性磷酸酶活性降低引起的遺傳性係統性疾病,以骨骼及牙齒硬組織發育不良以及血清堿性磷酸酶(ALP)活性偏低為特點。Strensiq為一種酶Asfotase alfa,可以通過替換缺陷的堿性磷酸酶,促進提高酶底物水平,提升機體骨礦物質化的能力,進而避免患者出現骨骼及其他器官嚴重異常和早夭。
美國FDA審批新藥主要是根據藥物化學類型和治療潛能來進行分類的。新藥按化學類型主要分為:1類新分子實體化合物(NME),創新性最強。指在美國從未作為藥品批準或銷售的活性成分,可以是單一成分,也可以是立體異構混合物中的一部分;2類新的衍生物。從已上市的活性成分(即所謂“專利”藥)化學衍生而來,即已在美國上市的活性成分的酯、鹽或其它非共價鍵衍生物,或者是去修飾基團的母體化合物未在美國批準上市的;3類新劑型。含有已上市活性成分的新劑型或新處方,其適應症可以與上市產品相同,也可以不同;4類新組合物。含有兩種或兩種以上已上市的活性成分的品種,上市產品中尚無這種組合;5類藥物新規格或新生產商;6類新適應症。由同一家公司或其他公司在美國批準或上市的具有新用途的複製品;7類已上市但未經NDA批準的藥品。適應症已與上市產品相同,也可不同;8類變為非處方藥;9類(New indication submitted as distinct NDA - consolidated with original NDA after approval); 10類適應症不同的新的新藥申請。

 相關新聞
相關新聞