CFDA關於征求《關於開展仿製藥質量和療效一致性評價的意見(征求意見稿)》意見的公告(2015年第231號)中,第二條明確了評價的對象和時限。對象為沒有按照與原研藥質量和療效一致的原則審批的已經批準上市的仿製藥,需按要求開展
一致性評價。
審評時限則分為兩個部分:一是2007年10月1日前批準的國家基本藥物目錄(2012年版)中化學藥品
仿製藥口服固體製劑,應在2018年底之前完成一致性評價,屆時沒有通過評價的,注銷藥品批準文號;二是2007年以前批準上市的其他仿製藥品和2007年以後批準上市的仿製藥品,自首家品種通過一致性評價後,其他生產企業的相同品種在3年內仍未通過評價的,注銷藥品批準文號。對於後一條自首家品種通過一致性評價後的3年期限,筆者本著大膽推測小心求證的原則,認為絕大多數產品均會在2018年底這個期限內完成。
麵對龐大數量的上市仿製藥批文,各生產企業和CDE同樣麵臨時間短任務重的問題。雖然因各種原因,近年來獲批的化藥批文數量有所減少,但由於早年存在對某些政策的誤讀,企業熱情高漲導致批文數量不少,並且由於認識上的誤差或者別的某些原因,絕大多數仿製藥沒有采用原研藥或國際公認的同種藥物作為自己產品的參比製劑。
這導致在第231號文出台後,出現了企業各種不同的表情:一些陷入急躁卻無從下手,一些故作淡定觀望,一些則積極投入人力物力開展相關試驗力圖搶得先機……無論企業表情如何,一場轟轟烈烈的一致性評價大戰在即,任何人任何企業都不能置身事外。
“早年歡喜近來愁”
仿製藥品種多、批文多的企業會患上選擇障礙症;幾年前獲得大數量批文而開心的企業,成為最鬱悶的企業
由於早年龐大批文數量的關係,本文僅對2007年以後批準上市的口服仿製藥品情況進行分析,看看哪些企業會成為“早年歡喜近來愁”的主角,哪些品種又會成為審查頻率高的主角。
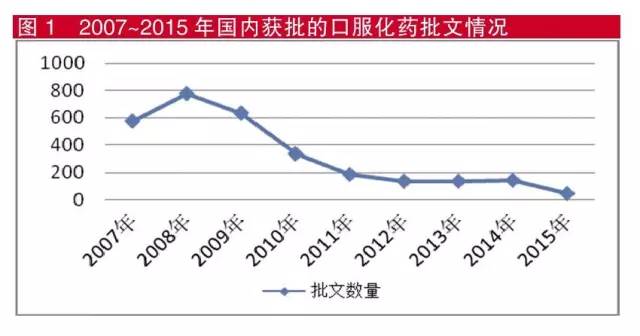
米內網藥物審評數據庫顯示,2007年至今,獲批口服化藥批文數量出現前高後低的態勢,高峰出現在2008年,2010年開始持續走低並保持了低迷狀態,這與近年來“在審藥品積壓嚴重”的情況相吻合。
由於此次對企業開展一致性評價的鼓勵政策,會通過企業最關心的醫保支付、招標、采購等方式實現,誰先通過再評價的利好有可預見性,企業的行動有可能從被動變主動。那麽在此項程序啟動後,那些仿製藥品種多、批文多的企業定會患上選擇障礙症——因為在短短3年內,優先開展哪些品種哪些劑型產品的再評價工作必然成為企業的重要選題。
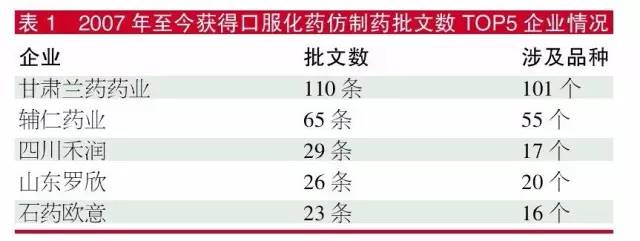
筆者對這幾年獲得口服化藥批文的企業進行數據歸納,發現2007-2009年是個別企業獲得大數量批文的年份,2010年以後企業一年內獲得超過10個口服化藥批文成為了稀奇事。幾年前獲得大數量批文而開心的企業,到今年的一致性評價時期則成為最鬱悶的企業。
數據顯示,雖然揚子江藥業集團和國藥集團等批文數量也不少,但由於分散到集團下屬的各子企業,壓力也分解了不少,相比表1的TOP 5企業鬱悶指數會小一些。
還有,此次需要再評價的雖然隻是化藥6類,但其實還有為數眾多的簡單改劑型的5類藥物,由於無需較高的技術要求,本質上也等同於仿製藥。進行這部分藥物的再評價工作應該隻是時間問題,如果執行此類品種再評價,鬱悶企業的隊伍還會有所增加。
紮堆批文“後傳”
時間不等人,留下能盈利有潛力的品種,同時舍棄多家擁有的非盈利品種已然提上日程
而在此段時間,有些藥物的批文出現紮堆現象,固然有市場好銷售旺的因素存在,也有企業因成本低廉而產生多報一個批文搶市場的心理,但這些品種卻成為被重點關注的對象。
由於曆史原因以及CDE對於企業申報資料隻有技術審評審批權限等因素存在,隻要企業進行產品注冊申報而且試驗資料合規,CDE就需要按程序受理並進行之後的相關技術審評審批,而不能因申報量的原因拒絕申報,由此導致一個品種出現幾十上百家企業手頭均握有批文的奇觀。
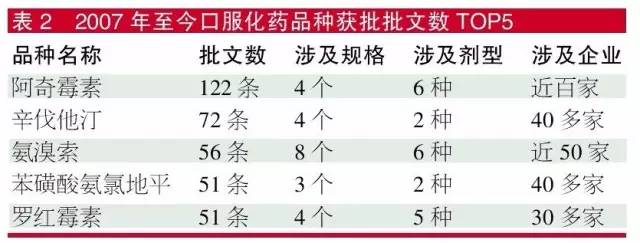
2007年至今,口服化藥品種獲批批文數TOP 5品種分別為阿奇黴素、辛伐他汀、氨溴索、苯磺酸氨氯地平、羅紅黴素,獲批批文數都超過了50個。其實,大家熟知的抗菌素左氧氟沙星,若包含鹽酸、乳酸及甲磺酸3個酸根的產品,批文也有57個。而審批數據庫顯示,上述TOP 5產品都還有數十家的注冊申請在排隊等待批準生產。
對於如此多的同品種批文數以及一個企業需要進行再評價的眾多品種,市場會給出什麽樣的反應呢?筆者推測,應該會出現一些明智企業舍棄某些批文的現象。這一推測來自注冊審批品種近期撤回事件:從11月11日CFDA主動公布8家企業11個藥品注冊申請不予批準的消息開始,到11月26日CFDA公布90家企業撤回164個藥品注冊申請的公告,再到12月3日CFDA公布62家企業撤回87個藥品注冊申請的公告,短短不到一個月的時間,市場反應神速。
如此,那些已上市品種再評價工作政策執行的路線圖已然劃出。雖然還有3年時間,但是對於擁有眾多品種批文的企業而言,時間不等人,下定決心留下能盈利有潛力的品種,將工作重心傾斜於它們,同時舍棄那些多家擁有的非盈利的品種已然提上了日程。


















 相關新聞
相關新聞