一致性評價究竟有多少藥做了?
開展仿製藥質量一致性評價,全麵提高仿製藥質量是《國家藥品安全“十二五”規劃》的重要任務,是持續提高藥品質量的有效手段,對提升製藥行業整體水平,保障公眾用藥安全具有重要意義。《國務院關於改革藥品醫療器械審評審批製度的意見》中提及要加快仿製藥質量一致性評價,力爭2018年底前完成國家基本藥物口服製劑與參比製劑質量一致性評價。在規定期限內未通過質量一致性評價的仿製藥,不予再注冊;通過質量一致性評價的,允許其在說明書和標簽上予以標注,並在臨床應用、招標采購、醫保報銷等方麵給予支持。質量一致性評價工作首先在2007年修訂的《藥品注冊管理辦法》施行前批準上市的仿製藥中進行。
輿論中,一致性的進度條似乎突然就加快了,似乎國務院此文一出就有許多產品的一致性評價都做完了。實際上國務院不過是再一次重申一致性評價責任是企業負責的,且有意讓企業自主發起一致性評價方法、標準及有關技術指導原則等方案的製定。此前2013年2月16日發布的《國家食品藥品監督管理局關於開展仿製藥質量一致性評價工作的通知》中提及的“國家食品藥品監督管理局組織相關技術部門及專家,按照給定的評價方法和標準,對藥品生產企業提出的仿製藥自我評估資料進行評價,評判其是否與參比製劑在內在物質和臨床療效上具有一致性。藥品生產企業是開展仿製藥質量一致性評價的主體。應按照公布的評價方法、標準及有關技術指導原則,以參比製劑為對照藥品,全麵深入開展與參比製劑的對比研究,解決影響仿製藥內在質量的關鍵問題,實現與參比製劑在內在物質和臨床療效方麵的一致”,則是一致性評價的責任在企業,標準和方法論主要由國家層麵包攬,企業可以負責起草個別品種的質量一致性體外評價方法和標準,但需要仿製藥質量一致性評價工作辦公室組織藥品檢驗機構進行複核,符合要求的,經公示及專家審查後對外公布。企業需按照國家公布的評價方法、標準及有關技術指導原則,以參比製劑為對照藥品,全麵深入開展與參比製劑的對比研究,解決影響仿製藥內在質量的關鍵問題,實現與參比製劑在內在物質和臨床療效方麵的一致。
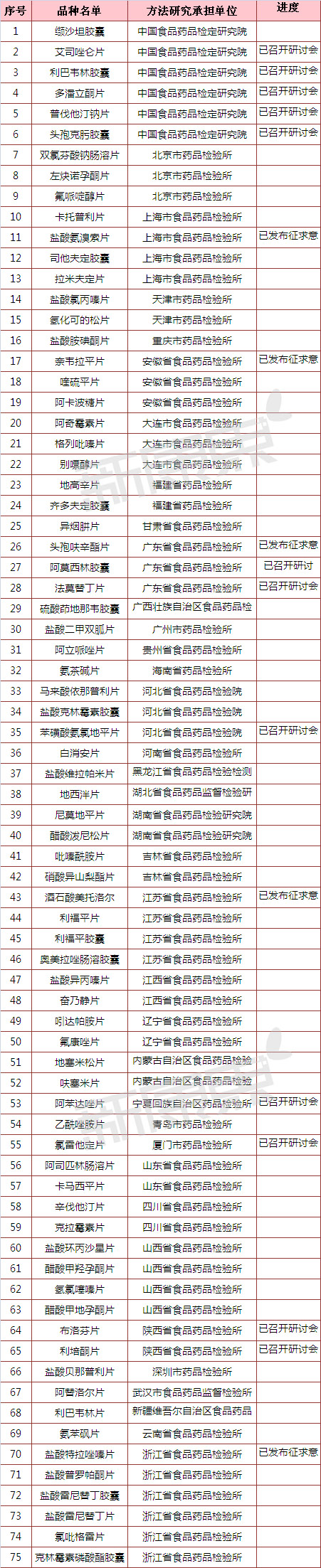
究竟有多少產品做了一致性評價呢?能拿60分及格分絕不拿61分的國內藥企而言,會主動參與的很少,畢竟沒有利益推動。國家層麵,按《國家食品藥品監督管理局關於開展仿製藥質量一致性評價工作的通知》,一致性評價的對象是2007年10月1日前批準的、對在國內外上市藥品進行仿製的化學藥品。同年發布《國家食品藥品監督管理總局辦公廳關於2013年度仿製藥質量一致性評價方法研究任務的通知》公布了75個產品的一致性評價品種名單和方法研究承擔單位匯總表。
如下表所示,中國食品藥品檢定研究院在2013年12月31日發布了關於征求《普通口服固體製劑溶出曲線測定與比較指導原則(草案)》意見的通知和關於征求《口服固體製劑參比製劑確立原則(草案)》意見的通知後,已發布征求意見的產品有5個,分別為鹽酸氨溴索片、奈韋拉平片、頭孢呋辛酯片、酒石酸美托洛爾和鹽酸特拉唑嗪片。艾司唑侖片、利巴韋林膠囊、多潘立酮片、普伐他汀鈉片、頭孢克肟膠囊、阿莫西林膠囊、法莫替丁片、苯磺酸氨氯地平片、阿苯達唑片、氯雷他定片、布洛芬片和利培酮片12個產品還在研討會階段,還有58個產品進度未明。
數據來源:中國食品藥品檢定研究院
中國食品藥品檢定研究院的評價標準製定明顯趕不上國家要求的進度條,再注冊壓力推動企業自行起草個別品種的質量一致性體外評價方法和標準,企業可參照FDA口服固體製劑溶出度方法數據庫中1138個產品數據和日本811個產品的再評價數據。

分享到:














 相關新聞
相關新聞