
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com





▲hjc黄金城同事(左2)代虞博士上台領取優秀青年論文獎證書
2017年5月6-8日,由中國毒理學會藥物毒理與安全性評價專業委員會主辦的“2017年中國毒理學會藥物毒理與安全性評價學術大會”在湖南長沙圓滿結束,會議吸引了五百多位相關科研學者到現場交流學習。經大會學術委員會擇優錄取,hjc黄金城臨床前部虞興博士在大會優秀青年論文評選活動中獲得優秀青年論文獎,在此向虞博士表示真誠的祝賀!
虞興博士受邀參加會議並向與會者作了題為“皮膚外用藥安全評價設計及注意點”的報告。虞博士基於hjc黄金城目前已完成的幾個皮膚外用藥安全評價試驗結果及研究中遇到的問題,主要針對皮膚外用藥體內無吸收時的安評設計及相關經驗心得向與會者作了介紹。下麵向各位分享虞博士的精彩報告:
一.皮膚外用藥安全性評價研究試驗設計
皮膚外用藥因其給藥途徑的特殊性,需要考慮體內有無吸收問題,體內吸收不同,其安全評價的實驗設計一般也會不同。
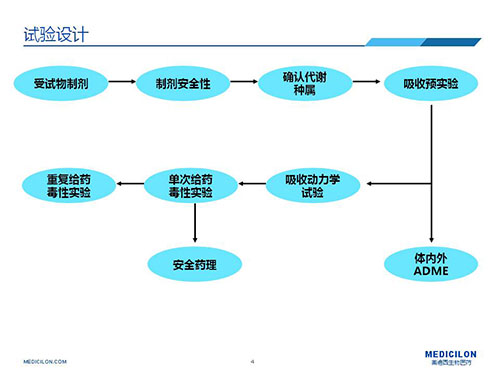
▲皮膚外用藥安全性評價研究試驗設計思路
皮膚外用藥安全評價可細分為:1)先直接評價受試物本身的安全性,再評價受試物的製劑安全性;2)或者直接評價受試物製劑安全性,據拿到的受試物實際情況而定。
二.關注各項試驗注意點


1)在開展製劑安全性試驗時,在安全性評價早期,我們會關注受試物是否與臨床擬用製劑一致,是否符合臨床用質量標準規定,以此確認製劑處方安全性,為單次和重複給藥毒性試驗提供參考信息;另外,我們會進行光敏實驗,事先了解供試品或製劑本身是否會發生光解;同時,鑒於很多皮膚疾病的皮膚屏障會有破損,所以會考慮增加破損皮膚對照組。
2)在進行一般毒理試驗時:對於單次給藥的急性毒性試驗,因為皮膚給藥體內無吸收或者暴露量低,一般會采用係統暴露的給藥方式,這對臨床的大麵積用藥、屏障喪失或者誤服也有指導意義;對於重複給藥的長期毒性試驗,一般采用與臨床一致的皮膚給藥方式,並會注意皮膚的多次刺激反應觀察,也可同時伴隨開展安全藥理試驗。為充分了解受試物的毒性,可增加一個相關種屬動物係統暴露途徑的重複毒性試驗。
三.皮膚塗抹試驗中,受試動物選擇小型豬更好

一般毒理試驗,齧齒類受試動物常規使用大鼠,小鼠;非齧齒類動物的選擇上,雖然有些皮膚外用藥選用犬作為受試動物,但是與犬相比,排除種屬相關性的問題,在皮膚塗抹試驗中,小型豬更好。原因如上圖所示。
hjc黄金城普亞目前已經開展了多項小型豬安全評價實驗和小型豬的PK試驗等,包括各種給藥途徑,積累了很多的臨床病理和組織病理背景數據,這也為我們開展小型豬試驗提供了很多便利。
四.“皮膚外用藥安全評價試驗”案例分享
巴馬小型豬經皮塗抹給予Med0421軟膏,四周恢複、四周重複給藥毒性試驗研究
一)案例基本情況介紹

我們的受試物,代號MED0421,其臨床擬用適應症為銀屑病,其作用機製為調節角質形成細胞的分化異常,改善角質形成細胞的過度增殖。前期研究顯示其製劑處方安全,代謝種屬比對結果顯示多個動物種屬與人體無太大的差異。因此在一般毒性實驗中我們設置了兩個種屬動物的口服單次給藥毒性試驗,兩個種屬的皮膚塗抹重複給藥毒性試驗,同時因為銀屑病病人的皮膚患處屏障破損,所以我們也增加了大鼠的口服重複給藥毒性試驗。另外也包括了體內和體外的AMDE試驗。
二)案例實驗設計
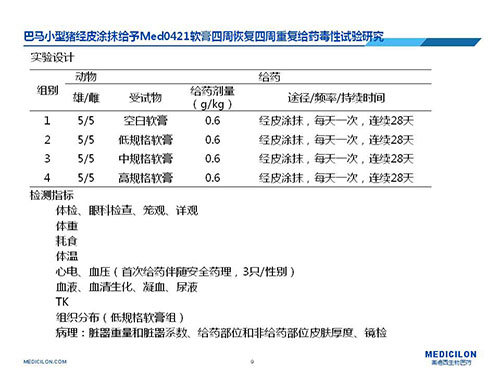
注釋1:因為在前期製劑安全性實驗中,臨床規格的製劑未出現任何毒性反應,所以從幫助委托方節約研發成本的角度考慮,實驗設計僅設置了空白軟膏組,而沒有設置絕對空白組;
注釋2:給藥劑量是根據動物體重計算得到給藥麵積,再換算到給藥劑量,小型豬皮膚最大給藥麵積為15%的體表麵積;
注釋3:考慮到受試物的作用機製,增加了藥效學相關指標即給藥部位和非給藥部位皮膚厚度的測量比較;
注釋4:關於檢測指標的設置,主要參考了重複給藥技術指導原則。
三)案例遇到的問題
1)在每天的詳觀中發現空白軟膏和Med0421軟膏組動物出現不同程度的紅斑、丘疹等皮膚刺激性反應;
2)同時,空白軟膏與受試物軟膏的皮膚反應程度不同,空白軟膏組動物給藥中後期皮膚症狀消失,而Med0421軟膏組動物直到停藥後皮膚逐漸恢複正常,皮膚刺激性反應評分結果顯示:低規格組≥中規格組>高規格組。
四)案例分析及問題解決

原因分析:1)在前期的製劑安全試驗中,臨床規格的軟膏未見刺激性反應,也就是說在兔和豚鼠以及藥效實驗中的小鼠上未見刺激性反應,於是,我們開始關注空白軟膏的輔料組成,並將目光鎖定輔料中某成分。該成分輔料為常規的皮膚用輔料,但沒有查到該成分在小豬皮膚上的毒性資料。2)我們開展了一項小豬皮膚刺激性拓展試驗,即塗抹空白軟膏和不含某成分輔料的空白軟膏,結果發現不含某成分輔料的空白軟膏小豬沒有出現皮膚刺激性反應。
結果判斷:1)綜合上述拓展試驗結果,我們判斷空白軟膏組出現皮膚刺激性可能是處方的種屬差異;2)關於Med0421軟膏組也出現了皮膚刺激性反應,但它的反應與空白軟膏組不一樣,皮膚刺激性隨劑量升高而減輕,這種情況與藥效的劑量效應曲線一致,並且FDA資料顯示同類型藥物也有該情況發生,即給予供試品的所有組別動物均出現皮膚刺激性反應,因此我們判斷該情況可能與供試品的治療作用相關。
結論:綜合體重、耗食、臨檢和病理等指標無異常,未發現係統毒性,與治療作用相關的皮膚刺激性反應我們認為風險可控,認為該供試品製劑可繼續開發。
我們在工作中遇到的每個受試物都有其各自的特性,因此在開展臨床前安評工作時,首先需要了解受試物的性質,包括適應症、作用機製等,並且前期研究需要重複透徹而不是貿然開展,遇到問題需綜合考慮。最後hjc黄金城十分願意就但不僅限於臨床前安評技術問題與各藥界同行進行探討交流,熱烈歡迎有需求的同仁谘詢。
 相關新聞
相關新聞