
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




2023年3月4日,科鎂信生物聯合創始人&副總裁張翼博士在基因治療閉門研討會—hjc黄金城核酸藥物研發專場中做了主題為《陽離子脂質高通量定製化篩選》的報告,本文根據專家報告內容整理,並經專家審核確認。

嘉賓簡介
張 翼 博士
科鎂信生物聯合創始人&副總裁
2021年回國,聯合發起創立科鎂信生物,擔任副總裁,負責公司戰略規劃,領導開發非病毒基因遞送平台。
張博士在Translate Bio(現賽諾菲)、Codiak和Beam therapeutics擁有10年的藥物遞送經驗,專注於核酸療法遞送技術。在他的整個職業生涯中,他致力於開發用於各種核酸治療的LNP輸送平台。在Translate Bio和Beam Therapeutics,他是脂質發現團隊的領先科學家,並發表了15項關於新型陽離子脂質的專利。他在三個mRNA LNP IND中發揮了關鍵作用,並推進至臨床。在科迪亞克,他領導了外泌體和核酸純化的工作。
張博士在複旦大學獲得高分子科學理學士學位,在德克薩斯大學達拉斯西南醫學中心獲得生物工程博士學位,在麻省理工學院和康奈爾大學接受了4年的藥物遞送博士後培訓。
核酸藥物最大的問題就是穩定性問題,我們知道RNA藥物是一個中間體,不穩定性是其與生俱來的一個缺點,也是生物進化當中對生命健康的一種保護。那如果要把一個不穩定的RNA這樣一個中間體做成藥的話,那麽一個有效的保護體係就是非常重要的。核酸藥物可以大體上分為小核酸和大核酸兩種,第一個被批準的siRNA藥物其實是用LNP來遞送的,但後來發現,小核酸是可以通過化學合成的,它的主鏈可以通過化學修飾而變得更穩定。LNP就不是一個必要的起到保護作用的遞送載體。但是對於mRNA或者其他的大核酸來說,化學修飾就不是一個可行的選擇,因為mRNA主鏈不能進行任何的修飾,它的不穩定性是與生俱來的。那麽LNP對大核酸來說還是非常重要的一個遞送載體。
目前LNP臨床階段已驗證的應用主要有被批準的Onpattro(siRNA)以及針對COVID-19的mRNA疫苗,同時在各管線產品中還有一些拓展應用,如CRISPR/Cas基因敲除、基因編輯/基因敲入、RNA編輯、環狀RNA、體內Car-T和腫瘤疫苗。
但是其實所有潛在的核酸藥物,包括siRNA和mRNA,以及DNA都是LNP可遞送的潛在對象,隻要帶正電,LNP就能對它進行有效包裹和遞送。
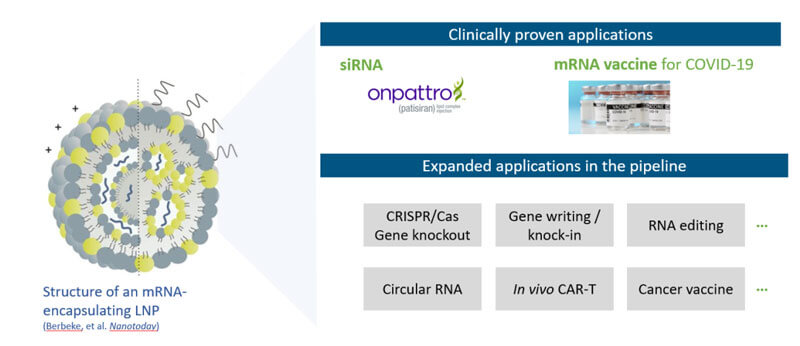
圖1 LNP的結構及其應用
我們人體的一些疾病是由於蛋白翻譯不正常造成的,不管是過高還是過低,我們都可以通過這個RNA藥物來對它進行治療。所以這個應用場景是非常廣泛的。不同的核酸不同的給藥方式以及不同的靶向性等這些因素是要靠我們的遞送係統來實現的。第一步就是要把核酸藥物準確地、高效地遞送到病灶,從而對疾病進行治療。現在有越來越多的證據證明,LNP可以有效地把核酸藥物遞送到不同的組織、不同的器官。
那大家對現在對這個陽離子脂質的重要性和價值的認識也越來越多,有很多工廠和一些新興的公司,都會采取一個對外合作或者收購的形式去彌補其在LNP這一塊的缺失。在當下LNP研發環境中,還是有一些挑戰和機遇,可以說挑戰和機遇是共存的。其中兩個是很重要的,第一個是我們要有自有專利的陽離子脂質,具有全球FTO和獨占性,就是我們常說的被卡脖子的一個技術環節。第二個是我們一定要找到適合不同應用場景的LNP來滿足不同的組織靶向性,從不同的給藥途徑來做出適合不同應用條件的基因治療表。
其實從2000年時,大家就已經對LNP進行研發了,可直到2020年,由於新冠,我們才有了第一個LNP作為遞送係統的mRNA藥物被批準。相對來說,這個發展還是比較緩慢。那製約LNP發展的因素主要有以下三方麵因素,不同的製約因素也決定了我們采用不同的策略。
我們知道,陽離子脂質的結構對於LNP的遞送效率是至關重要的。大家也在嚐試設計不同結構的陽離子脂質,但是到目前為止,大家都沒能建立一個有效的構效關係。我們不知道怎樣結構的陽離子脂質具有高效的遞送效率,具有特殊的靶向性。為解決這個問題,我們采取網篩的策略。也就是說,如果我們篩100個,篩不到,那我們就篩200個、500個,甚至1000個,直到篩到我們想要的結構。簡言之,就是我們篩得越多、越快,就會有更高的機率得到一個我們想要的陽離子脂質。
我們在細胞實驗上,比如篩選出比較好的陽離子,就可以把它放到動物體內去做表征的時候,發現這個藥效完全是一個相反的結果。細胞實驗非常好,然後動物實驗當中沒有任何蛋白表達。也就是說,在LNP的研發過程當中,我們沒有辦法使用傳統的高通量、低成本的細胞實驗對其進行一個預篩選,那我們隻能在這個低通量和高成本的動物實驗上對它進行表征。
前麵提到LNP的應用場景有很多不同的核酸載荷、不同的給藥方式。也就是說,每一種應用場景其實對LNP都有一個特殊的需求。我們發現不同的核酸、不同的給藥方式,對不同的LNP有不同偏好。這就使得我們要去對LNP進行一個定製化的開發,讓它適合不同的應用場景。
基於這三個因素,我們覺得傳統研發思路不適用於LNP。理想的LNP研發平台需要滿足以下幾點:
1. 強大的陽離子脂質庫;
2. 高通量體內篩選;
3. 針對載荷、靶點以及給藥方式的定製化開發。
其中三大核心能力主要體現在:
我們設計新型脂質骨架結構,月產出100-1000種高純度陽離子脂質體來進行內部高通量篩選,並且圍繞新型脂質體結構申報具有全球技術壁壘的知識產權。
可應用於遞送效率以及不同組織靶向性的動物水平的高通量篩選平台,可以進行高效篩選通量可達每日上百種LNP,且有效節約成本。
我們針對不同脂質體結構開發最優製劑工藝,采用新型生產工藝賦予LNP特殊功能,利用堅實的工藝放大生產產業經驗。
這三大核心能力需要解決的事情、實現的目標有兩個:更高遞送效率、更好耐受性的肝靶向陽離子脂質;具有高效肝外靶向的陽離子脂質。
我們這樣LNP篩選平台能夠幫助我們去解決到一些傳統研發手段所不能解決的問題。這個篩選的起點都是從我們具有自主知識產權的陽離子脂質庫開始的。我們會對所有合成出來的陽離子脂質,通過靜脈給藥的方式,進行一個體內藥效的初篩,得到高藥效脂質。然後我們再會把這部分篩選出來陽離子脂質,在動物實驗上進行進一步的篩選。比如,除了靜脈給藥方式,我們也會考察其他的給藥方式,看不同LNP適合哪種給藥方式,我們同樣也會從核酸載荷和靶向性方麵進行定製化篩選。然後我們還將這些LNP進行進一步的耐受性篩選。最終篩選到的少數LNP被認為是藥效高、耐受性好的LNP。(如圖2)
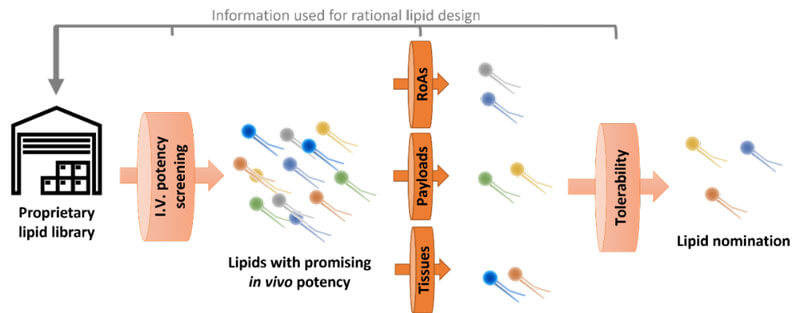
圖2 科鎂信LNP篩選流程
通過設計並篩選“成千上萬”個陽離子脂質,我們能:
1.根據不同應用定製LNP;
2.拓寬新的專利空間;
3.加快建立基於大數據分析得到的構效關係,從而指導陽離子脂質結構設計。
接下來,張翼博士還分享了科鎂信LNP高通量篩選平台取得的一些進展。首先是高通量合成和篩選方麵,在過去的半年多時間內,我們已經合成並篩選了700個自主知識產權的陽離子脂質,並希望在今年年底,這個數量能夠達到2500個,篩的更多,篩的更快,從而得到更好的陽離子脂質結構。
同時我們也評估了這些我們設計出來的陽離子脂質的體內核酸遞送效率,找到了有80個陽離子脂質,表現出了比MC3 LNP更高的蛋白表達效率,其中有兩個LNP是達到十倍的翻譯效率。那我會把這80個LNP放到其他的應用場景上,進行進一步的篩選。那我們針對這80個LNP當中挑選出適合不同應用場景的LNP,即進行定製化篩選。比如適合靜脈給藥的CPL-180和CPL-092, 適合肌肉給藥的CPL-457, 適合基因編輯工具的CPL-455,以及適合靶向T細胞的CPL-180等。
除了陽離子脂質篩選呢,我們也會利用我們獨特的工藝開發優勢解決LNP目前的一些短板。
1. 第一個優勢就是解決耐受性問題。我們知道陽離子脂質是作為一個帶正電的小分子,它的生物安全性、耐受性始終是被大家詬病了一個地方。大家采取一個策略就是不斷的降低它的劑量來去減緩這個問題。但降低劑量的同時,又將出現一個藥效問題。而我們就可以用相同的LNP去做到更高的蛋白表達。從數據看,科鎂信獨有的生產工藝可提高MC3 LNP和ALC-0315 LNP的體內藥效,在藥效和耐受性之間取得一個平衡。
2. 第二個優勢就是我們通過自主工藝的開發,做出了穩定的LNP,同時我們發現在老鼠體上還具有更高的蛋白表達效率。數據證明,得到的穩定PEG-free ALC-0315 LNP有更高的體內藥效。因為我們知道LNP和mRNA藥物通常是需要重複給藥的,那人體內的anti-PEG抗體會識別並清除所有LNP。在我們以往的研發過程中,發現LNP給藥次數越多,藥效就會降低。那如果我們做出一個穩定的PEG-free的LNP,就能從根源上去解決這個問題。
3. 第三個優勢是我們通過工藝開發方式,通過增加LNP表麵修飾,達到主動靶向性。到目前為止,LNP都是被動的靶向。解決這個問題辦法就是增加LNP表麵的修飾。主要一個難點就是怎麽將靶頭接到LNP的表麵。因為我們知道LNP是利用正電和負電的相互吸引,來形成一個自組裝的結構。如果我們把一個富集電荷的結構(如多肽),接到LNP表麵上的話,會極大地影響LNP的穩定性,不能夠穩定存在,就不能工藝放大。
然後另外一點是,我們知道很多這種帶有主動靶向性的靶頭、帶有功能性的靶頭,通常都是帶正電的。在我們傳統的工藝下,這些帶正電的靶頭會傾向於和帶負電荷的核酸結合成complex,而不是按照我們設計主動的去待在LNP的表麵。所以說這個LNP的表麵修飾是比較難做到的一個事情。那目前我們也是通過一些工藝的優化,做出多肽修飾的LNP。我們發現沒有修飾的LNP,它在脾髒上麵是沒有任何的表達。然後我們修飾之後,我們可以看到脾髒的蛋白表達有極大的提高。實驗表明,表麵修飾的LNP表現出主動靶向性。
最後張翼博士總結了科鎂信陽離子脂質高通量篩選平台的三個驅動引擎:
每月能生產~1g mRNA以支持體內篩選實驗。工藝開發至百克級別 mRNA生產,以支持管線開發。單通道混合生產達20g LNP。
每周300隻小鼠協助體內篩選。並且具有超10種不同給藥方式進行定製化篩選。
每月測試1-2個新的脂質家族 ;每月合成200個高純度科鎂信專利結構脂質;每月合成~1000個LNP。我們相信在這三個引擎的推動下,科鎂信今後能更好地去迭代陽離子脂質,然後找出適合我們臨床應用的陽離子脂質。
LNP是核酸類藥物的核心和價值所在。但陽離子脂質結構設計鮮有指導原則、體內篩選實驗低通量和高成本、以及缺乏針對不同核酸載荷/給藥方式的定製化開發這個三方麵製約了LNP的發展。基於製約因素,科鎂信LNP團隊設計新型脂質骨架結構,建立高通量LNP篩選平台,開發最優製劑工藝,實現獲得更高遞送效率、更好耐受性的肝靶向LNP,以及具有高效肝外靶向的LNP的目標。
