
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com





2023年12月8日,美國FDA批準了兩款具有裏程碑意義的療法——Casgevy和Lyfgenia。
這是首批用於治療12歲及以上鐮刀型細胞貧血症 (SCD)患者的基因療法,且Casgevy是FDA批準的首款基於新型基因編輯技術的基因療法,今年11月已在英國獲批。
Casgevy(exagamglogene autotemcel,exa-cel),由CRISPR與Vertex共同研發,利用CRISPR/Cas9基因編輯係統,在體外對來自患者的造血幹細胞進行編輯,使血紅細胞生產高水平的胎兒血紅蛋白(HbF)。
HbF是人類胎兒期自然存在,攜帶氧氣的血紅蛋白形式,但在出生後其基因便會迅速被沉默,並隨著成長轉換為成人形式的血紅蛋白。對於SCD患者而言,HbF的存在能夠抑製異常鐮刀型紅細胞的產生,提升攜氧能力,大幅改善患者的溶血性貧血和血管阻塞現象。
通過Casgevy治療,可以提高HbF水平,有可能緩解輸血依賴性β地中海貧血患者的輸血需求,並減少鐮刀型細胞貧血病患者的疼痛和使人衰弱的血管閉塞性危象。
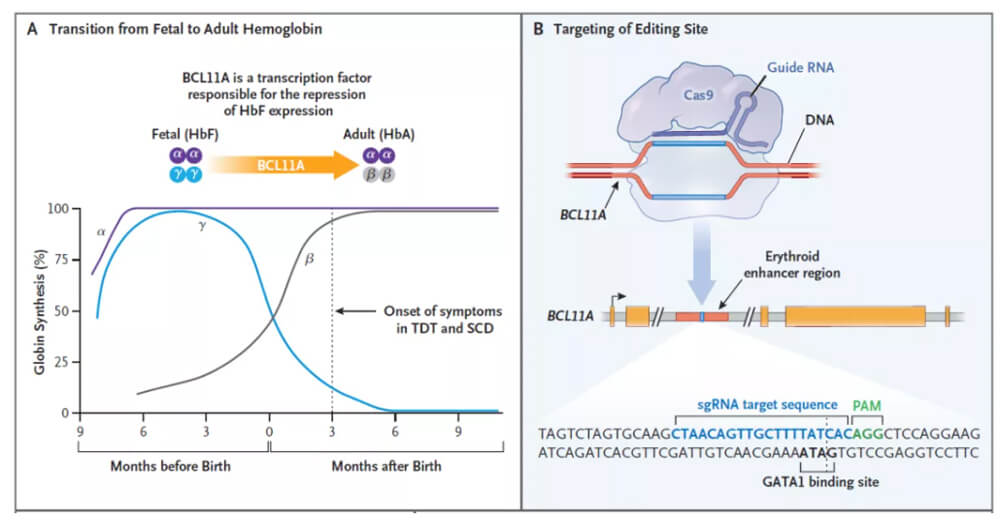
Casgevy的作用機製
A:BCL11A是下調胎兒血紅蛋白表達的轉錄因子
B:對BCL11A進行基因編輯,上調血紅蛋白表達
Lyfgenia(lovotibeglogene autotemcel,lovo-cel),藍鳥生物自主研發,基於慢病毒載體技術,利用基因編輯後的慢病毒在體外感染患者的造血幹細胞,將血紅蛋白A的一種變異型——HbAT87Q基因,引入患者的造血幹細胞中。
HbAT87Q型與野生型HbA具有相似的氧結合能力,限製紅細胞鐮狀化,並有可能減少血管閉塞事件。相比於SCD患者體內攜帶的突變體血紅蛋白,HbAT87Q擁有著非常好的穩定性,攜帶它的紅細胞更不容易出現溶血或血管內聚集等現象。
在臨床研究中,以上兩種療法在SCD人群中都展現出了良好的療效,基因編輯與慢病毒改造造血幹細胞技術並駕齊驅,分別是兩大領域的裏程碑式進展。
SCD由β-珠蛋白(構成血紅蛋白的一種蛋白質)的特定基因突變引起,這種突變降低了血紅蛋白的溶解性並增加了紅細胞的不穩定性,因此,患者體內存在著大量鐮刀狀的異形紅細胞。
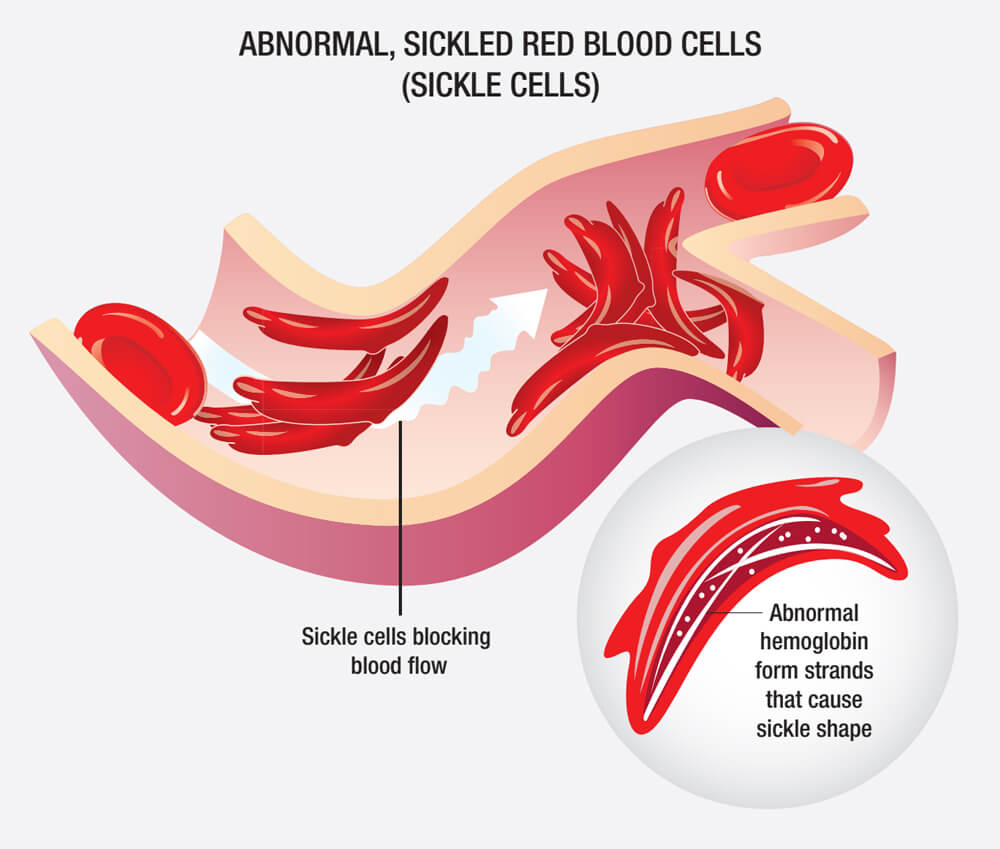
鐮刀狀異形紅細胞(圖源:NIH)
SCD患者既存在異常血紅蛋白誘發的持續性、溶血性貧血,同時也會因異形紅細胞聚集導致血管堵塞。此外,大部分患者會因疾病的反複發作而逐漸失去脾功能,出現免疫力低下、全身多器官並發症,嚴重影響生活質量,甚至猝死。
Casgevy的獲批就像打開了潘多拉魔盒,想要使用這項隻有10年研究曆史的超強工具,就得勇於接受安全性的挑戰,包括可能存在的脫靶效應、效率問題、免疫排斥和片段丟失等技術難點。
隨著更多基因療法的獲批,生物分析方麵的挑戰接踵而至,特別是跟免疫原性評估相關的問題。當治療劑通過免疫介導的清除、中和或細胞免疫反應引起阻斷治療產品功效的免疫反應時,可能導致多種免疫相關毒性。
免疫原性數據是監管部門批準療法的必備條件,以評估療法短期及長期的安全性和有效性。由於基因治療本身的複雜性,在對其進行免疫原性測試時我們就需要考慮更多因素:給藥途徑/方案,患者/適應症,載體生物學特征,表達產物特性,導入基因特性等。
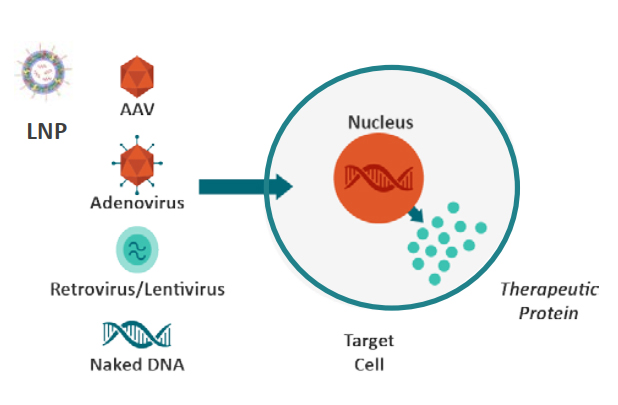
基因療法的構成
針對基因治療產品的免疫原性可能涉及一下3點:
❖ 病毒載體直接激活的固有免疫反應,產生急性毒性。
❖ 預先存在的抗病毒載體或產物蛋白的中和性抗體。
基因療法通常是多組分藥物,而不僅僅由單一分子組成,也不單純由一個融合分子或多域分子組成。這些藥物成分包括傳遞載體、經傳遞的核酸以及由核酸編碼的治療蛋白,每個成分都會引發不同的免疫反應。這也意味著,安全和療效問題可能涉及到基因藥物結構的多種元素。
❖ 針對病毒載體和產物蛋白引起的適應性體液免疫和適應性細胞免疫反應。
❖ 預先存在的抗病毒載體或產物蛋白的中和性抗體。
基因療法還能引發多種體液和細胞反應,這意味著生物分析評估不僅僅是關注抗體的產生。與此同時,先天性免疫和適應性免疫之間存在著多種橋梁:比如活化的巨噬細胞一旦攻擊了吞噬細胞入侵者,就可以充當抗原代表細胞(APC)。
在此基礎上,遵守對使用基因治療產品的患者進行長期隨訪(LTFU)的監管標準非常重要。Casgevy的研發公司Vertex建議,在試驗參與者接受治療後對其進行15年跟蹤隨訪,以觀察長期影響。
2021年12月3日,CDE頒布了《基因治療產品長期隨訪臨床研究技術指導原則(試行)》;而美國FDA和歐洲藥品管理局(EMA)都在各自的監管協議中設立了與長期隨訪相關的規定。這類評估有助於監測患者的延遲不良事件(如延遲毒性),確保患者的長期安全,並指導確定最佳的治療方式。
Editas Medicine的EDIT-301(renizgamglogene autogedtemcel,reni-cel),也是一款基於CRISPR基因編輯技術的體外基因編輯藥物,目前正在進行I/II期臨床試驗。近日在美國血液學會(ASH)年會上,Editas Medicine公布了共17位患者的最新數據。

Editas Medicine 官網海報
❖ RUBY試驗:用於治療嚴重SCD(n=11),所有患者均未發生血管閉塞事件(VOE)。
❖ EdiTHAL試驗:用於治療輸血依賴性β-地中海貧血(n=6),所有患者的總血紅蛋白均早期穩步升高,且高於輸血非依賴性閾值9 g/dL(n=6)。
❖ 藥物安全性:迄今為止,兩項試驗均耐受良好,並在所有患者中陸續顯示出與白消安清髓性預處理和自體造血幹細胞移植一致的安全性特征(n=17)。未報告與reni-cel治療相關的嚴重不良事件(SAE)。
Intellia Therapeutics的NTLA-2001,是全球進展最快的體內CRISPR基因編輯藥物,正在進行臨床III期試驗,用於治療轉甲狀腺素蛋白澱粉樣變性心肌病和轉甲狀腺素蛋白家族性澱粉樣多發性神經病,通過降低血清中TTR的濃度來治療ATTR澱粉樣變性。
NTLA-2001應用LNP肝髒遞送係統,攜帶靶向人TTR基因的sgRNA和經過優化的化膿性鏈球菌Cas9蛋白的mRNA序列。
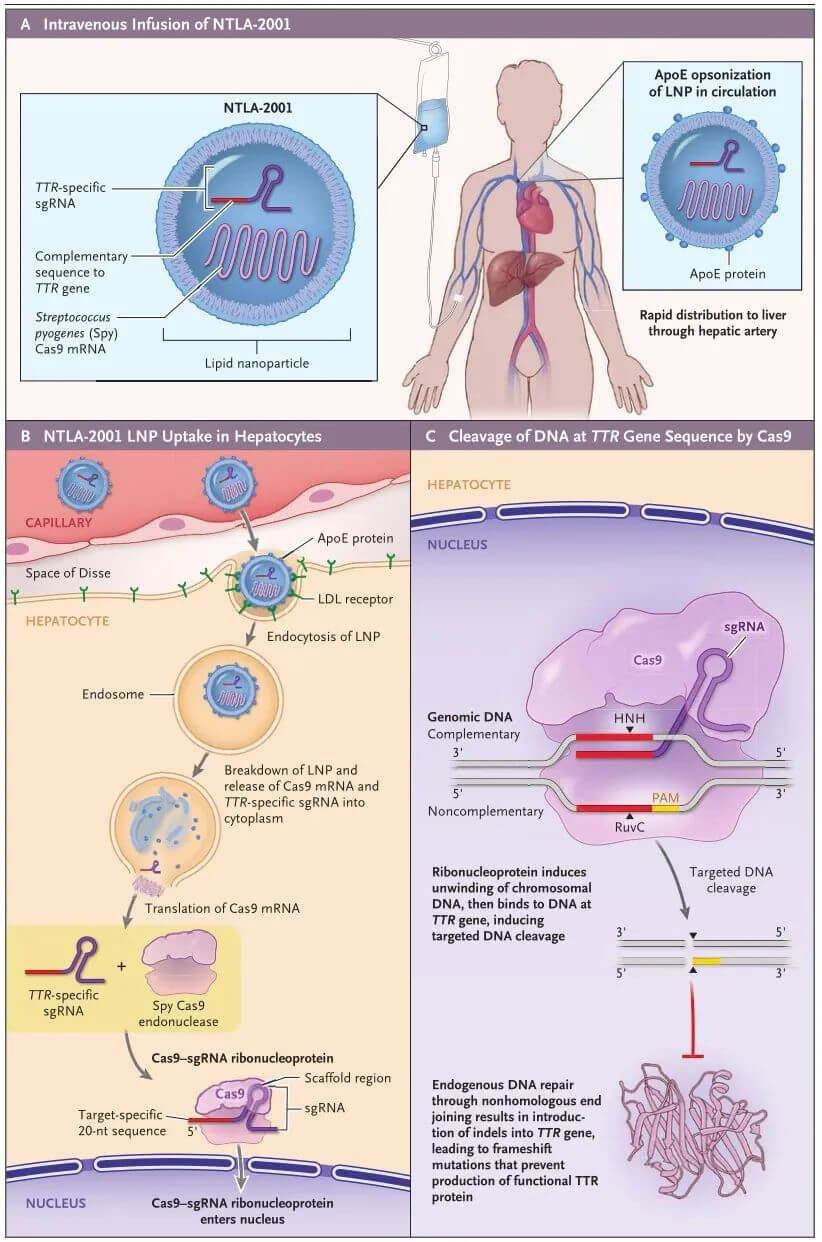
NTLA-2001的作用機製(來源:新英格蘭醫學雜誌)
其他還包括:
❖ Beam Therapeutics的BEAM-101,依托堿基編輯技術,用於治療SCD和β-地中海貧血。
單堿基編輯(single base editing)作為一種最新的基因編輯工具,能夠在不導入雙鏈斷裂的情況下直接進行堿基的替換,具有編輯效率高和特異性強的特性,為精確基因修飾提供了一種更簡單、更有效的方法。
❖ 應用先導編輯技術的Prime Medicine,目前管線均處於臨床前階段。
Prime editing(PE)是一種精準的基因編輯技術,可以在細胞和動物中以可編程方式安裝替換、插入和缺失,而無需雙鏈DNA斷裂 (double-strand DNA breaks, DSBs),具有多功能性、特異性和精確性的優勢。
在毒理學研究中,應對基因治療產品進行全麵的安全性分析評估,必要時還應評估導入基因的表達產物的安全性。基因治療產品應能在相關動物種屬中有效導入/暴露。
基於國際認證的AAALAC質量標準和依從國際、國內GLP規範的藥物安全性評價質量管理體係,自2008年以來,hjc黄金城持續對標國際水準,高質量完成GLP的安全性評價服務,建立了長期的品牌效應。我們可以開展涵蓋多毒性終點的係統評價服務,並擁有國際認可的病理學研究支持我們的安全性評價研究。
hjc黄金城在藥物安全性評價方麵有專業的團隊和實戰經驗,可提供高質量的數據和快速的周轉期以支持各項藥物安全評價研究。毒理學研究可按照non-GLP或GLP標準執行。我們的研究平台已被評為上海研發公共服務平台。截至2022年底,hjc黄金城已完成12個IND申報全流程項目(包括原料藥、製劑、PD、PK和安全性評估)。
如您對本期話題有進一步想要了解的內容,或您希望hjc黄金城Marketing討論更多行業資訊,歡迎點擊:文章最下方「發消息」給我們留言互動。期待您的"美"思妙想~

marketing@yakkaa.com
微信或郵件聯係我們
1.https://www.fda.gov/news-events/press-announcements/fda-approves-first-gene-therapies-treat-patients-sickle-cell-disease
2. Frangoul et al., (2020). CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia. NEJM, DOI: 10.1056/NEJMoa2031054.
3. 官網公開資料
 相關新聞
相關新聞