COVID-19患者存在血栓性動脈和靜脈阻塞的高風險,SARS-CoV-2感染可通過多種可能的協同機製導致大血管和微血管血栓形成,其中包括激活白細胞、內皮和血小板的細胞因子風暴;缺氧性血管閉塞,並通過病毒感染直接激活免疫和血管細胞。在COVID-19中,微觀凝塊可能會限製肺部的血液流動,從而損害氧氣交換。
抗磷脂綜合征是一種獲得性血栓形成症,患者會產生針對磷脂和磷脂結合蛋白(aPL抗體)的致病性自身抗體,這些自身抗體接合的細胞表麵激活內皮細胞、血小板和嗜中性粒細胞,從而使血液-內皮界麵向血栓形成方向傾斜。抗磷脂綜合征的一個關鍵特征是它能夠促進各種大小血管床(包括動脈和靜脈回路)血栓形成的能力。抗磷脂綜合征的災難性變體通常是致命的,並且與COVID-19患者所見的彌散性凝血病具有某些相似性。
在近日的《Science Translational Medicine》上發表了一篇文章,研究人員發現一大半患嚴重COVID-19的患者表現出高水平的危險抗體和超活化嗜中性粒細胞,這些都是具有嚴重破壞性的白細胞。研究人員表示“來自活躍COVID-19感染患者的抗體在動物體內引起了驚人的凝結,這是我們見過的最嚴重的凝結。”為了了解更多信息,研究人員在小鼠模型中一起研究了中性粒細胞和COVID-19抗體,以查看這是否可能是血塊背後的危險組合,最終發現了使COVID-19的患者血凝的機製。

住院COVID-19患者血清中aPL抗體的患病率
研究人員對172例接受住院治療的COVID-19患者的血清樣本進行了八種不同類型的aPL抗體評估,在測試的各種aPL抗體中,aPS / PT IgG的患病率最高(24%),其次是aCL IgM(23%)和aPS / PT IgM(18%)。41位患者(24%)的一種以上aPL抗體呈陽性,13位患者(8%)的兩種以上aPL抗體呈陽性,52位患者(30%)至少具有一種中高滴度aPL抗體。36位患者在多個時間點采集的血清樣本可用於aPL抗體測試,從而可以進行縱向分析。使用最高的aPL抗體血清滴度對這36例患者進行陽性分類,為了進一步闡明在aPS / PT抗體呈陽性的血清樣本中自身抗體的抗原特異性,研究人員在這些血清樣本中測量了抗磷脂酰絲氨酸自身抗體(aPS抗體)。aPS IgG和aPS IgM均與aPS / PT抗體血清滴度無關,這表明COVID-19患者血清中的aPS / PT抗體主要識別凝血酶原。總之,大多數陽性血清樣品與三種類型的自身抗體相關:aPS / PT IgG,aCL IgM和aPS / PT IgM。
aPL抗體的臨床相關性
接下來,研究人員評估了aPL抗體與血氧飽和度、吸入氧分數、血清中C反應蛋白、血漿中D-二聚體濃度、血小板計數、絕對嗜中性粒細胞計數、血清鈣衛蛋白(嗜中性粒細胞活化的標誌物)和血清中髓過氧化物酶-DNA複合物。aCL IgM的滴度與所有這些臨床和實驗室變量相關,鈣衛蛋白指示的血清中性粒細胞活化與aPL抗體的存在最一致。
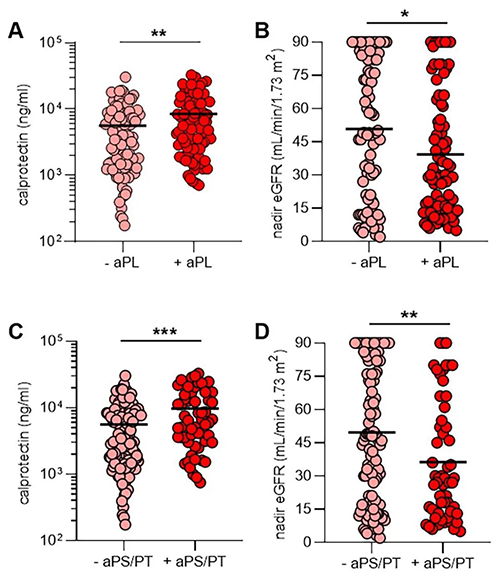
aPL抗體、NET釋放和腎功能
然後,研究人員檢查了與每個ELISA測試的陽性aPL抗體閾值相關的臨床變量。任何aPL抗體的陽性試驗均與血清中較高的鈣衛蛋白(p = 0.009)和較低的臨床估計腎小球濾過率(eGFR,p = 0.03)有關。當將患者aPS / PT抗體陽性的血清樣本與該隊列其餘部分的血清樣本進行比較時,也觀察到這些關聯(鈣衛蛋白p = 0.0008;eGFR p = 0.008)或不含aPL抗體的血清樣品(鈣衛蛋白p = 0.001;eGFR p = 0.01)。有腎髒疾病史的患者的最低蛋白GFR低於無腎髒疾病的患者(p = 0.01)。與血清樣品中缺乏aPL或aPS / PT抗體的患者相比,aPL或aPS / PT抗體陽性的患者的氧合效率趨於受損,盡管組間的比較沒有統計學意義。同樣,對於任何aPL抗體或抗PS / PT抗體呈陽性的患者,血清中的肌鈣蛋白峰值和血漿中的D-二聚體峰值往往較高。鑒於肥胖會影響血漿中D-二聚體的濃度,研究人員比較了有無肥胖的COVID-19患者的D-二聚體血漿濃度,但沒有發現差異。
從COVID-19患者血清中分離的IgG觸發NETs的釋放
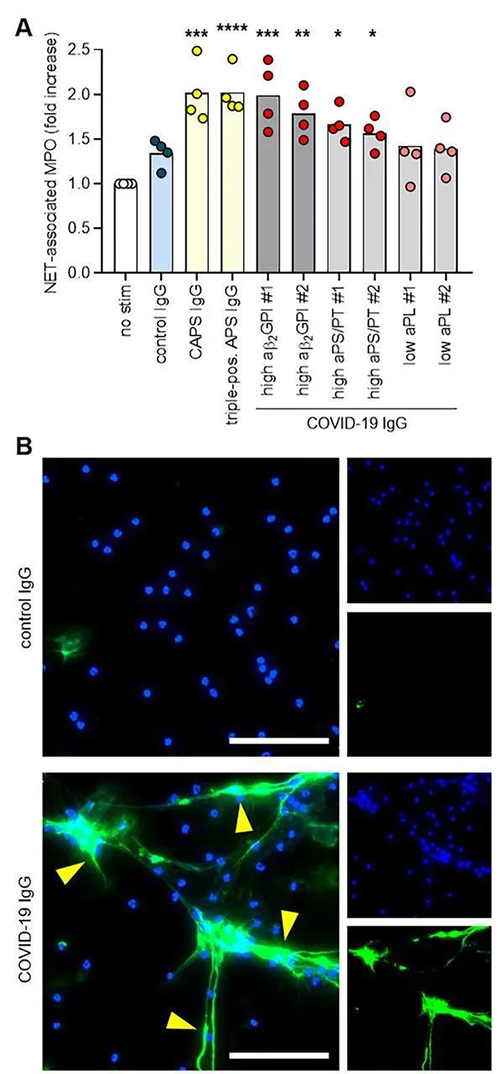
COVID-19患者IgG在體外促進從正常嗜中性粒細胞釋放NET
鑒於最近檢測到COVID-19患者血清中的NETs升高,研究人員認為從COVID-19患者血清中純化的IgG組分可能會觸發NET釋放。研究人員選擇了兩名血清aPS / PT IgG高的COVID-19患者和兩名缺乏血清aPL抗體的COVID-19患者,通過SDS-PAGE驗證了COVID-19患者IgG的純度。為了定量體外NET釋放,研究人員測量了用微球菌核酸酶消化NET DNA後釋放到上清液中的MPO活性。從健康個體中分離的嗜中性白細胞的NET釋放增加了一倍(與未刺激的嗜中性白細胞相比),這類似於抗磷脂綜合症(p < 0.0001)或災難性抗磷脂綜合症(p = 0.0001)患者的IgG樣品在中性粒細胞中誘導的NET釋放程度。先前已經證明,雙嘧達莫是一種抗血栓藥物,可以通過受體激動作用來減弱aPL抗體介導的血栓前NET釋放。在這裏,研究人員發現雙嘧達莫還抑製了COVID-19患者IgG介導的NET從嗜中性粒細胞中釋放,從aPL抗體陽性的COVID-19患者血清中純化的IgG組分促進了NET釋放,類似於從已建立抗磷脂綜合征的個體中分離的IgG。
從aPL抗體陽性的患者血清中分離的IgG可增強小鼠血栓形成

來自COVID-19患者的IgG增強了小鼠的血栓形成
接下來,研究人員試圖確定來自COVID-19患者血清中的IgG是否可以加速血栓形成。在體外無細胞凝血酶生成測定中進行測試時,從COVID-19患者血清中純化的IgG餾分沒有明顯的血凝塊加速活性。盡管如此,研究人員推測在富含細胞的小鼠血管環境中仍可能觀察到血栓前表型。首先將銅線放置在小鼠模型下腔靜脈內,以通過電解介導自由基的生成。在該模型中,從IgG靜脈注射後24小時,從血清中具有較高aPS / PT IgG血清滴度的COVID-19患者中分離出的IgG增加了血栓延伸和總體積聚。高aPS/PT血清滴度樣品還增加了小鼠血清中的NET殘留物(p= 0.0004),類似於來自災難性抗磷脂綜合征患者的IgG(p= 0.0014),並通過Western印跡法證明了在小鼠血栓中瓜氨酸化組蛋白H3(NETs的生化標記)表達更高的趨勢。
結果與討論
抗磷脂綜合征最嚴重的表現是它的災難性變體,在感染、手術或抗凝藥撤離等應激條件時會影響少數患有抗磷脂綜合征的患者。災難性的抗磷脂綜合症涉及炎症和血栓形成途徑的紊亂,並同時影響體內的多個器官。在災難性抗磷脂綜合征患者中,受影響最常見的器官是腎髒、肺部、腦部、心髒、和皮膚。多器官功能衰竭肯定會使嚴重的COVID-19病例複雜化,而肺髒通常是受影響最嚴重的器官。研究人員推測由於病毒感染(包括潛在的內皮細胞感染)引起的局部免疫刺激可以與循環的aPL抗體協同作用,從而導致對COVID-19患者的肺部造成特別嚴重的血栓炎性損害。
來自抗磷脂綜合征患者的血清樣本以及純化的aPL抗體會觸發嗜中性粒細胞釋放NETs,已在aPL抗體介導的大靜脈血栓形成的小鼠模型中證實了這一觀察結果的潛在體內相關性,其中中性粒細胞耗竭具有保護作用。來自抗磷脂綜合征患者的嗜中性粒細胞似乎也具有增加的粘附潛力,這取決於整聯蛋白Mac-1的活化形式。這種前黏附表型擴大了中性粒細胞-內皮的相互作用,增強了NET的形成,並潛在地降低了血栓形成的閾值。靶向NET形成的療法具有治療血栓疾病的潛力。在COVID-19中,aPL抗體的產生可能會增強NET的形成和BAFF的釋放,這可以進一步提高磷脂反應性B細胞的存活和分化,並且在某些情況下可以類別轉換為IgG同種型。COVID-19和體液免疫之間的相互作用顯然是一個值得進一步研究的領域。
這些發現有一些潛在的臨床意義,目前抗凝藥和皮質類固醇激素在COVID-19的治療中均顯示出一定的前景。同時,恢複性血漿作為治療COVID-19嚴重病例的一種方法也受到越來越多的關注。在當下等待針對當前COVID-19大流行的確定性抗病毒和免疫學解決方案時,測試aPL抗體(包括aPS / PT抗體)可能會改善COVID-19患者的風險等級和個性化治療。研究人員表示還需要進一步研究aPL抗體對COVID-19的複雜血栓炎性環境的作用。
hjc黄金城視頻號
歡迎關注hjc黄金城官方視頻號!我們將帶您走進臨床前研究,走進新藥研發,走進hjc黄金城,走進健康與陽光!


















 相關新聞
相關新聞