根據Frost & Sullivan預測,2016年至2021年,全球生物類似藥將以53.7%的年複合增長率增長,於2021年銷售額達到366億美元。據悉,目前中國生物類似藥研發數量已經超過印度,位於全球前列。
目前國內生物類似藥市場仍屬空白,但產品的研發進度以及和原研的相似性決定了上市的節奏,誰能夠率先獲批,誰就能享受先發優勢。
從目前國內涉足生物類似藥開發的企業來看,主要可以分為以下四類:
第一類,如複宏漢霖、信達生物、嘉和生物等研發驅動型企業,生物類似藥與生物創新藥產品兩手抓,目前還沒有建立完整的市場銷售能力。
第二類,如齊魯製藥、海正藥業等綜合型醫藥企業,具備從原料藥到製劑的研發、生產和銷售產業鏈,近年逐步重視發展生物藥業務。
第三類,如三生國健、複旦張江等以生物藥為主要方向的醫藥創新型企業,已經有個別上市銷售產品,具備從研發、生產到銷售的完整能力。
第四類,以合作形式推動生物類似藥上市。例如先聲藥業和安進達成戰略聯盟在國內引入後者4款生物類似藥;喜康生物和賽諾菲達成合作,後者獲得利妥昔單抗生物類似藥等在華權益,喜康將主導藥物的研發、注冊及生產,賽諾菲將負責藥物在中國的商業化運作。
本文根據藥物臨床試驗登記與信息公示平台以及企業官網搜集的信息,綜合四個標準(1.生物類似藥產品線豐富;2.有多個處於臨床晚期階段的生物類似藥;3.生物類似藥臨床項目基本處於進展狀態;4.在生物類似藥布局上具有獨特的商業模式或商業思路),總結出目前國內涉足生物類似藥領域的五類“黑馬”特質的企業。
1. 進可攻,退可守,仿製創新齊步走
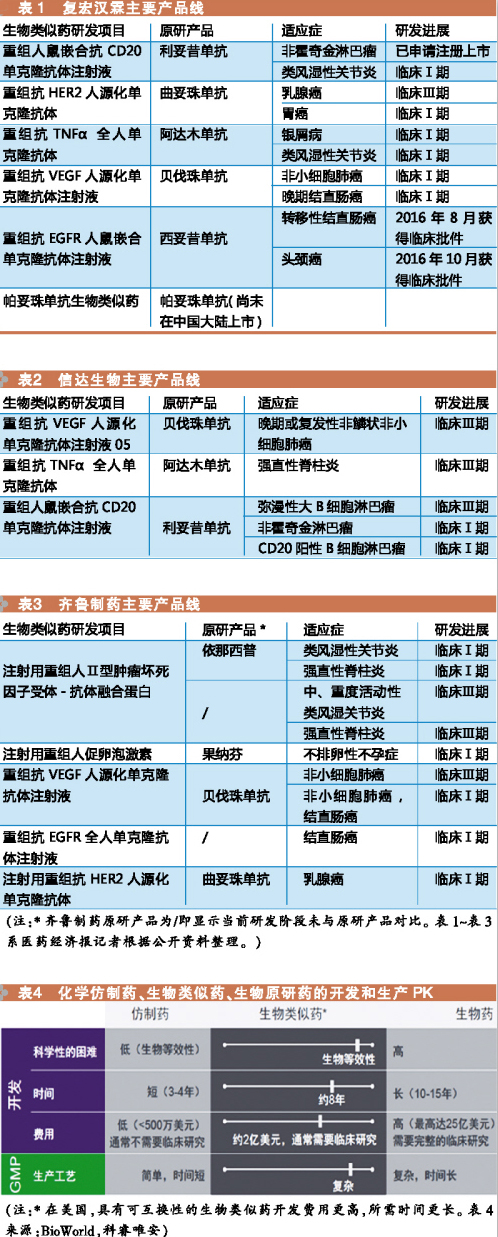
標杆:複宏漢霖
目前國內涉足生物類似藥開發的企業中,有一類企業采納生物類似藥與生物創新藥產品齊頭並進的策略。這種策略以複宏漢霖為代表。
根據官網資料顯示,目前複宏漢霖已完成8個產品、13項適應症IND申報的高效研發,其中6個產品已經全部獲得CFDA的11項適應症的臨床批件,3個項目進入臨床Ⅲ期,其中首個項目HLX01(重組人鼠嵌合抗CD20單克隆抗體注射液)已向CFDA遞交NDA申請。
為了使生物類似藥做到質優價廉,目前複宏漢霖采取了3個技術策略降低成本:第一,高表達的細胞株,一般普通的細胞株單抗產量是每升1克左右,公司改良的高表達細胞株表達量能達到每升2~3克。第二,自主研發培養基,然後委托國外公司生產,比直接采購進口培養基便宜75%。第三,兩條生產線,可進行多產品生產,降低生產成本。2015年底公司完成了符合國際GMP標準、采用國際先進的一次性生物反應器等設備的抗體藥物中試以及產業化生產基地的建設。
在生物藥布局方麵,複宏漢霖采取“進可攻、退可守”戰略。一方麵,致力於在已得到臨床驗證的靶點上進一步尋求差異化開發,如果臨床試驗中顯示出和已上市藥物類似的藥效和安全性,可以依靠自身成本優勢開拓國內市場,並進入其他新興國家市場。目前公司研發的赫賽汀生物類似藥已經獲得烏克蘭衛生部、菲律賓食品藥品監督管理局批準開展轉移性乳腺癌適應症的Ⅲ期臨床試驗。另一方麵,如果臨床試驗中顯示出比已上市藥品更高的藥效與安全性,則可選擇和國際大藥廠合作,進軍國內市場與歐美市場。
值得注意的是,複宏漢霖是複星醫藥的控股子公司,而後者在大健康產業擁有豐富的資源,複宏漢霖有望通過與複星旗下子公司如商業保險加強合作,提高生物類似藥的可及性,這也是國內其他生物類似藥企業所不具有的優勢。
2. 低風險起步,從仿製快速轉向創新
標杆:信達生物
有一類企業,以風險較低的生物藥類似藥起步,目前正從生物藥仿製向生物藥創新轉向。
這種策略的典型代表是信達生物。
經過六年發展,立足創新的信達生物已經建立起了一條包括12個新藥品種的產品鏈,覆蓋腫瘤、眼底病、自身免疫疾病、心血管病等四大疾病領域,建成了符合CFDA、FDA和EMA的GMP標準的大規模產業化基地。
據悉,信達生物曾全程參與《生物類似藥研發與評價技術指導原則》的起草和製定,目前公司研發的針對CD20、TNF-α、VEGF三個靶點的生物類似藥均處於Ⅲ期臨床試驗,基本位列第一梯隊,預計明年上半年可能開始報生產。
據信達生物有關人士介紹,公司現在正在建設自己的銷售團隊,銷售模式以自己為主,有幾個產品與禮來合作,定價低於原研,但質量是一定要保證的。公司以癌症用藥為主營產品,銷售策略跟一般藥不一樣,不需要營銷力覆蓋很寬。選擇生物類似藥也是因為風險最低,公司希望從生物類似藥轉到自主創新靶點,很快往創新藥發展。
目前信達生物的PD-1抗體已申請上市,產品管線中還有其他腫瘤免疫產品處於不同臨床開發階段,這也有利於與生物類似藥產品形成組合療法進一步擴大市場空間。
此外,公司與禮來建立了合作夥伴關係,或可借助後者在銷售等方麵的資源在市場中打響品牌。
3. 主攻創新,借力類似藥轉讓搭建合作網絡
標杆:康寧傑瑞
另一類企業,以創新生物藥為主攻方麵,其生物藥仿製藥開發的目的還是為了創新生物藥。這種策略以康寧傑瑞為代表。
成立於2009年的康寧傑瑞儼然是生物藥領域的明日之星。公司憑借抗體篩選平台、早期藥效評價平台、多功能抗體平台,以及大分子工藝開發平台,形成了生物創新藥和生物類似藥豐富的產品線。
根據湯森路透2015年發布的《中國生物類似藥發展報告》,康寧傑瑞以28個生物類似藥項目拔得頭籌,其中既包括主要治療自身免疫係統疾病、腫瘤的TNF-α、VEGF、HER-2等熱門靶點的生物類似藥,也有治療骨質疏鬆、糖尿病、不孕不育等疾病的生物類似藥。目前公司生物類似藥項目在完成小試工藝後,絕大部分都已經轉讓或處於待轉讓狀態,轉讓對象包括麗珠藥業、正大天晴、中信國健。
康寧傑瑞董事長徐霆曾表示,從產品角度考慮,公司做生物類似藥的優勢在於做得早、做得快、工藝水平做得足夠像。但這是過去式,畢竟可供仿製的生物藥品種本身就十分有限。
對於康寧傑瑞而言,公司的主要精力仍在開發重組人促卵泡激素Fc融合蛋白注射液KN015、以PD-L1為靶標的免疫治療納米抗體藥物KN035等生物創新藥上。轉讓生物類似藥項目的更大意義在於,通過生物類似藥的轉讓合作,形成了與其他企業合作開發的關係網絡,這為日後的新藥合作奠定了基礎。
4. 立足綜合實力,強勢切入生物藥
標杆:齊魯製藥
綜合型醫藥企業,具備從原料藥到製劑的研發、生產和銷售產業鏈,近年逐步重視和發展生物藥這一炙手可熱的領域。以齊魯製藥為代表。
作為一家綜合性醫藥研發生產企業,齊魯製藥的業務涉及製劑及其原料藥的研製、生產與銷售等多個領域。近年生物藥在國內外掀起的熱潮,也讓齊魯製藥把目光轉向了這一炙手可熱的領域,公司在腫瘤藥領域和神經用藥領域積累的豐富經驗,將有助於其未來生物藥包括生物類似藥上市後的銷售等。
根據官網介紹,齊魯製藥在生物醫藥板塊主要以重組單抗藥物為重點研發方向,在研產品19項,具有自主知識產權。其中,10個品種屬重磅炸彈級單抗類靶向治療藥物,2個品種列入十二五“國家重大新藥創製”科技專項臨床重大疾病治療急需藥物。
從生物藥產品線來看,齊魯製藥算是綜合型醫藥企業中布局較廣的企業,除了正處於臨床階段的項目外,仍然在陸續申報新的項目。或許受到近年逐漸完善的生物類似藥政策影響,注射用重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白在今年另外開展了針對類風濕性關節炎、強直性脊柱炎的Ⅰ期臨床試驗,並以原研藥依那西普作為對照。
5. 乘改革東風,加快海外產品引入
標杆:先聲藥業&安進
隨著進口藥注冊政策開放,境外國際多中心臨床試驗數據符合中國新藥上市要求的,允許申辦方將其作為藥品注冊申請的內容。這一方麵有利於加快把高質量的生物類似藥引進國內,另一方麵節省下來的注冊成本也將為海外生物類似藥在國內落地提供更大的議價空間。以先聲藥業與安進的合作為例。
2017年9月26日,先聲藥業與安進宣布簽署獨家合作協議,將在中國市場共同開發及商業化4種生物類似藥,涵蓋風濕免疫、腫瘤領域。安進將繼續負責這4種生物類似藥的共同開發、上市許可申報和生產。先聲藥業將負責生物類似藥在中國市場的共同開發和商業化,安進公司保留特定的產品共同推廣權。
引發關注的是,已經公布的2個項目為FDA批準的各自品類的第一款生物類似藥,即治療類風濕疾病的阿達木單抗Amgevita和治療腫瘤的貝伐珠單抗Mvasi。















 相關新聞
相關新聞