2017已經過去,我們迎來了2018全新的一年。回首昨天,醫藥行業走過了不容易卻也是各有收獲的一年,筆者為大家精心準備了2017年藥品注冊專題係列文章。
國內新藥申請總體情況
2017年已經過去,對於醫藥界,業內最關注的也許就是年度新藥申報情況,以下我們一起來看看。
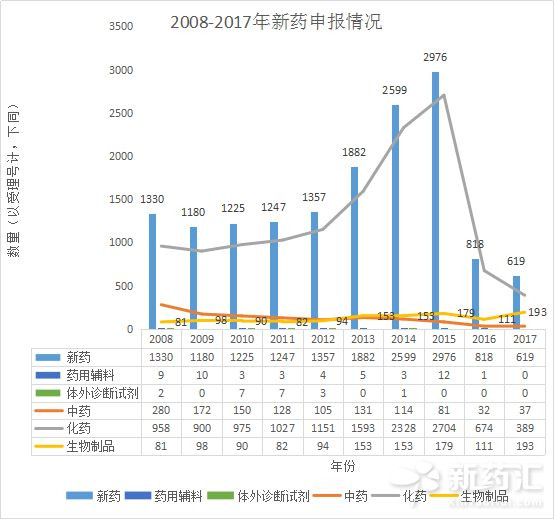
圖1 2008-2017年新藥申報情況
從圖1可以看出近十年新藥的整體申報趨勢,2015年達到申報高峰,為2976個(以受理號計,下同),2016年大幅度下滑。化藥新藥申報情況與總體趨勢一致,這與化藥仿製一致性評價、食藥監局對醫藥市場的規範化監督有密不可分的關係。2017年截至12月31日,總的申報數量相比2016年有所降低,為619個。值得一提的是,我們可以看到在近十年間,生物製品新藥的申請總體態勢趨好,今年達到最高為193個,這也是與近幾年生物醫藥發展熱相契合。
2017年新藥申請情況
1、生物製品新藥申請情況
1.1各地區申報情況
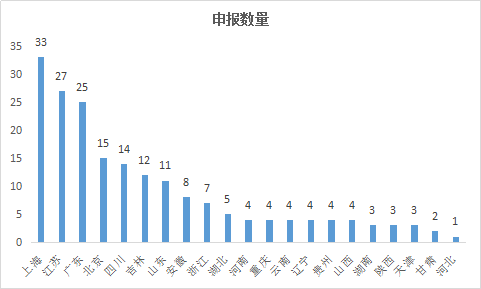
2017年生物製品新藥申請地區熱度,數量排名靠前3的為上海、廣東、江蘇。
圖2 2017年各地區生物製品新藥申請情況
1.2企業申報情況
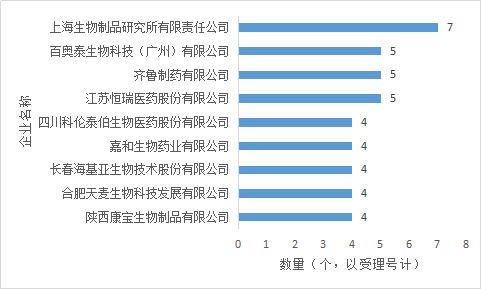
生物製品新藥申請中,數量最多的為上海生物製品研究所,達7個;其次是齊魯、江蘇恒瑞、百奧生物,申報5個藥品。
圖3 2017年生物製品新藥申請企業排名
1.3生物製品1類申請
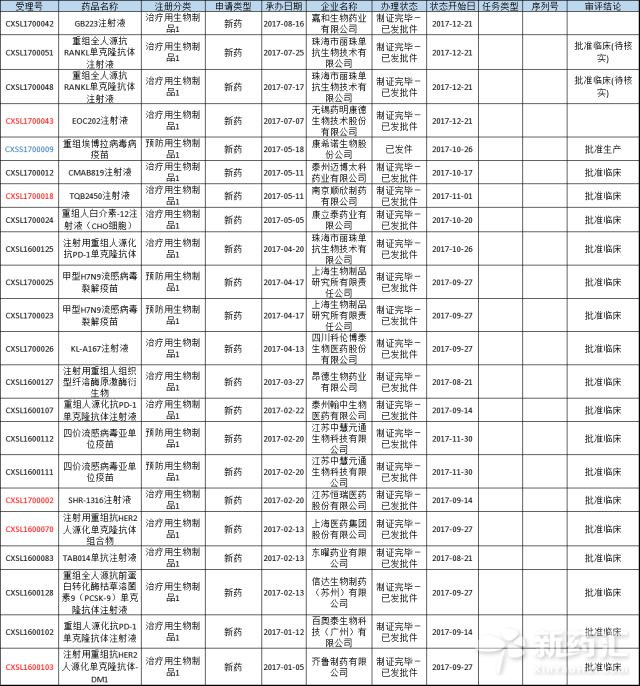
2017年生物製品1類(未在國內外上市銷售的治療用生物製品、未在國內外上市銷售的疫苗)申請共計76個,占總的39.38%,其中製證完畢已發批件的有22個(如表1所示),其餘54個均還在審評審批中。另外在這些1類新藥申請之中有28個特殊審批、2個優先審評。
表1 2017年生物製品1類新藥申請獲批情況
(注:紅色為特殊審批,藍色為特殊、優先審評,由於篇幅有限,僅選取已經製證完畢的藥物,完整數據請點擊“閱讀原文”,進入藥智新聞下載)
1.3.1特、優品種重組埃博拉病毒疫苗
2017年生物製品1類新藥的重頭戲可說就是重組埃博拉病毒疫苗,從開始到最終批準生產都受到國內外廣泛關注,這也是新一輪政策之下國家藥審中心的一次創舉。康希諾生物公司至此也在大眾視野火熱了一把,也為今後的發展打好了基礎。
1.3.2五個特殊審批品種獲批臨床
國內名企齊魯製藥、江蘇恒瑞、上海醫藥集團、南京順新、無錫藥明康德今年申報的五個特殊審批品種獲得了臨床批件。其中齊魯製藥的注射用重組抗HER2人源化單克隆抗體-DM1也獲得了臨床批件,此藥是齊魯的潛力生物製品。另外上海醫藥的研發重心產品注射用重組抗HER2人源化單克隆抗體組合同樣在今年獲批臨床,此藥是新型人用重組單克隆抗體製品,擬用於 HER2 陽性的轉移性乳腺癌,國內外已上市的同靶點同類藥物包括:羅氏製藥的曲妥珠單抗(Herceptin)和帕妥珠單抗(Perjeta)。而上海醫藥的注射用重組抗 HER2 人源化單克隆抗體組合物具有自主知識產權,目前在國內無相同產品上市。
1.3.3珠海麗珠單抗
今年珠海麗珠單抗有3個(以受理號計)藥品獲批臨床,收獲很大,分別是兩個規格的重組全人源抗RANKL單克隆抗體注射液以及注射用重組人源化抗PD-1單克隆抗體。國內能夠自主研發單抗創新藥的龍頭企業本就不多,而麗珠就是其中一位。PD-1單抗是第一個上市的免疫檢查點單抗,國內外市場規模巨大,目前國內沒有上市,且目前國內獲批臨床以“PD-1”為靶點的單抗藥物廠家共計9家,競爭雖然激烈,但麗珠研發紮實、技術工藝沉澱深厚,前景良好。
1.3.4 常見病毒疫苗獲批臨床
上海生物製品的H7N9基因疫苗從剛開始研製成功就受到廣泛的關注,這為今後病毒防治打下了良好的基礎。2017年9月,甲型H7N9流感疫苗批準臨床。另外江蘇中慧元通研發的四價亞單位流感疫苗也在2017年11月獲批臨床,中慧元通此疫苗對流感病毒感染的預防具有更好的安全性,能夠更好地保護3歲以下嬰幼兒,其產品不僅能夠填補國內外市場空白,還將為接種人群提供安全性更好、保護範圍更廣的預防流感的疫苗產品。
2、化藥新藥申請情況
2.1各地區申請情況
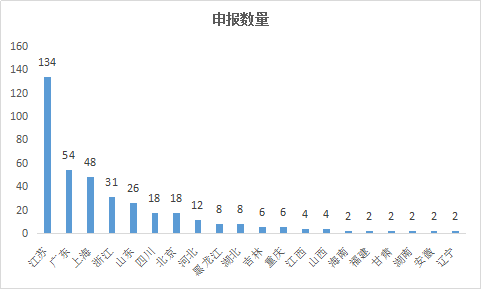
化藥一直是研發的大類,2017年的新藥申請雖然不如以往,但也仍舊比中藥、生物藥有優勢。在全國各地區中我們可以看到申報數量較多的為江蘇、廣東、上海、浙江。均是沿海發達城市,也是製藥大企業聚集所在地(如圖5所示)。
圖4 2017年各地區化藥新藥申請情況
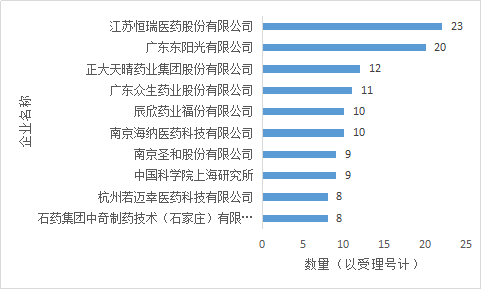
2.2企業申報情況
化藥新藥申報排名前三的企業為江蘇恒瑞、廣東東陽光、正大天晴(包含子公司正大天晴有14個受理)。江蘇恒瑞、正大天晴曆來為化藥研發名企,其實力經久不退。廣東東陽光今年潛力爆發,在化藥新藥的申報上趕超其他公司,可說是厚積薄發。從2013年至2017年,東陽光共計在藥審中心申報新藥64個,其中化藥63個,其中有12個特殊審批、4個優先審評、3個重大專項:磷酸依米他韋原料藥、兩個規格的磷酸依米他韋膠囊,化藥1(1.1)類共計53個。在總的新藥申請中除了埃索美拉唑鎂腸溶膠囊的兩個批件不批準,其他全部批準臨床。可見廣東東陽光雖說在總的數量上不如有些企業,但其布局的少量藥品均是市場好藥,研發實力在節節攀升。
圖5 2017年化藥新藥申請企業排名
2.3 化藥1(1.1)類新藥申請
2017年化藥新藥1(1.1)類共計申報324個,占比83.29%,可見雖然2017年化藥新藥有所減少,但1(1.1)類新藥同比卻增加了34.57%。其中製證完畢-已發批件的藥品有174個(如表2所示),審批完畢-待製證的8個,製證完畢-待發批件的1個,總計審評完畢的占比56.48%。從數據可以看出,國家如今追求的不再是製藥數量大國,而是藥品質量大國。同時國家布局新藥的戰略逐步成熟,審評審批速度逐漸加快,不會再出現累積大量審評的情況。
表2 2017年化藥1類新藥申請獲批情況
(注:滑動查看數據表,紅色為特殊審批,由於篇幅有限,僅選取已經審評完畢的藥物,完整數據請點擊“閱讀原文”,進入藥智網下載)
2.3.1化藥1類申請排名前三:東陽光、恒瑞、廣東眾生
2017年廣東東陽光申報的20個化藥1類新藥(按受理號計,下同)批準臨床,這份戰績讓人歎服。分別為利他匹侖及其片劑、康達瑞韋鈉及其片劑、HEC68498鈉鹽及其膠囊劑、HEC30654AcOH及其膠囊劑、HEC74647PA及其膠囊劑;恒瑞有12個化藥1類新藥獲批臨床,分別為SHR9549及其片劑、SHR9146片劑、SHR0532片劑、SHR8554注射液、SHR1459片劑;廣東眾生藥業共計10個1類新藥獲批臨床,分別為ZSP0391及其片劑、ZSP1603及其膠囊。
2.3.2 117個特殊審批獲批臨床
2017年被列入特殊審批的化藥1類新藥,有117個獲批臨床,占特殊審批總數的96.69%,審評效率較高。
2.3.3 吉林英聯尚德的化藥1.1類
2017的化藥1.1類相對較少,僅有兩個受理號,為吉林英聯尚德科技開發有限公司的苯唑嗪及其膠囊劑(如表3所示),適應症為原發性輕、中度高血壓,對於單獨用藥難以控製血壓的患者,可與利尿劑、β受體阻滯、鈣拮抗劑或血管緊張素轉化酶抑製劑(ACEI)合用。
表3 2017年化藥1.1類新藥申請情況
(注:紅色為特殊審批)
3、中藥新藥申請情況
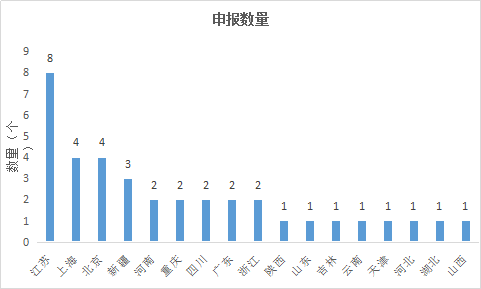
3.1各地區申請情況
中藥新藥申報地區分布較多的為江蘇、上海、北京,這幾個地區也是中醫藥產業較為發達的地區。
圖6 2017年各地區中藥新藥申請情況
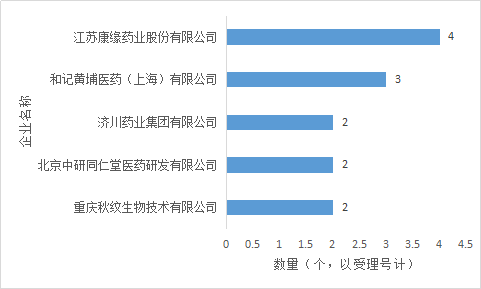
3.2企業申報情況
中藥新藥申報企業排名靠前的為江蘇康緣藥業、和記黃埔醫藥、濟川藥業集團、北京中研同仁堂、重慶秋紋。雖然數量不及化藥、生物藥,可以說是很少,但是在中藥發展不利的環境之中,仍舊能夠有新的中藥研發,實屬不易。
圖7 2017年中藥新藥申請企業排名
3.3 中藥新藥申請
2017年中藥新藥申請總數不多,僅37個(如表4所示),相比2016年僅增加了5個。隨著社會對藥品質量要求的攀升,對於藥品安全的追溯要求也越來越嚴格,中藥在發展中遇到了一些阻力。但就在2017年《中醫藥法》正式實施,也在為中藥開通新的發展渠道。2017年無疑是中藥在新時代新政下的適應期,我們也相信經曆此前的低穀,會有不一樣的新狀態出現。
表4 2017年中藥新藥申請情況
(注:紫色為優先審評)
3.3.1新時期新發力,重慶秋紋中藥1類
2017年12月CDE承辦了重慶秋紋公司中藥1類新藥JNSW10032以及其片劑的IND申報,目前在審評審批中。這也是2017年唯一一個中藥1類新藥。據公開信息,重慶秋紋公司於2017年8月1日成立,經營生物技術研發、新藥及醫療器械的研發及技術轉讓。可以預測這個產品將會成為公司未來的品牌。
3.3.2 25個6(6.1)類新藥
中藥新藥承辦中,6類較多,有25個受理號,占比67.57%。其中小兒清疹口服液、培土清心顆粒被列為優先審評之列,目前已經批準臨床。另外還有天胡膠囊、補氣通絡顆粒也已經批準臨床。

















 相關新聞
相關新聞